
| A.L层 | B.K层 | C.N层 | D.M层 |
科目:高中化学 来源: 题型:
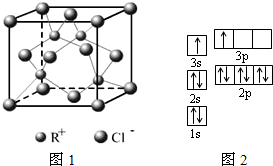
 2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED).目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如图.试回答:
2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED).目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如图.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
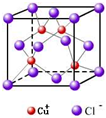
 (1)下列是部分金属元素的电离能
(1)下列是部分金属元素的电离能| X | Y | Z | |
| 第一电离能(kJ/mol) | 520.2 | 495.8 | 418.8 |
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列是部分金属元素的电离能
下列是部分金属元素的电离能| X | Y | Z | |
| 第一电离能(kJ/mol) | 520.2 | 495.8 | 418.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省南充高中高二第一次月考化学试卷 题型:填空题
(20分)(1)在同一个原子中,离核越近、n越小的能层中的电子能量越 。理论研究证明,多电子原子中,同一能层的电子,能量也可能不同,还可以把它们分成能级,第三能层有3个能级,分别为3s、3p和 。现代物质结构理论证实,原子 的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做 原子。
的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做 原子。
(2)写出下列基态原子的简化电子排布式:
①14Si ;②26Fe 。
(3)按所示格式填写下表中的空格:
| 原子序数 | 原子的价电子排布式 | 周期 | 族 |
| 17 | | 第三 | |
| | 3d54s1 | | ⅥB |
 。
。 杂化,分子的立体构型为 。
杂化,分子的立体构型为 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com