
| A. | 9 mol/L | B. | 8 mol/L | C. | 5 mol/L | D. | 10 mol/L |
分析 n(Cu)=$\frac{4.51g}{64g/mol}$=0.07mol,硝酸与铜反应可能生成NO,NO2、NO的物质的量共为$\frac{2.24L}{22.4L/mol}$=0.1mol,被还原的硝酸的物质的量等于生成NO2、NO的总的物质的量,硝酸反应后生成硝酸铜、NO和NO2,根据N原子守恒可计算硝酸的物质的量浓度.
解答 解:n(Cu)=$\frac{4.51g}{64g/mol}$=0.07mol,硝酸与铜反应可能生成NO,NO2、NO的物质的量共为$\frac{2.24L}{22.4L/mol}$=0.1mol,
则反应中消耗HNO3的物质的量为2n[Cu(NO3)2]+n(NO)+n(NO2)=2×0.07mol+0.1mol=0.24mol,
所以原硝酸的物质的量浓度至少为$\frac{0.24mol}{0.03L}$=8.0mol/L,
故选B.
点评 本题考查化学方程式的计算,注意把握硝酸的性质,解答本题的关键是把握氧化还原反应的特点,从质量守恒的角度解答该题,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | SO2和SiO2 | B. | SiH4和H2S | C. | NaCl和HCl | D. | CCl4和KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它只有一种氧化物Cs2O | B. | 它与水剧烈反应 | ||
| C. | Cs+具有很强的氧化性 | D. | CsHCO3受热不易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 取溴代烃少许,加入AgNO3溶液 | |
| B. | 取溴代烃少许与NaOH水溶液共热,然后加入AgNO3溶液 | |
| C. | 取溴代烃少许与NaOH乙醇溶液共热后,加入稀硝酸酸化后,再加入AgNO3溶液 | |
| D. | 取溴代烃少许与NaOH水溶液共热后,加入稀硝酸酸化后,再加入AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的颜色随核电荷数的增加逐渐加深 | |
| B. | 氢化物的稳定性随核电荷数的增加逐渐减弱 | |
| C. | 单质与水反应均可表示为X+H2O=HX+HXO | |
| D. | 随核电荷数的增加卤素原子的半径递增,卤素离子的还原性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
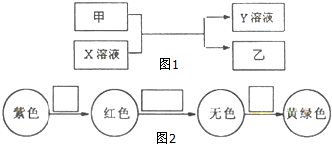
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-C(CH3)2-CH3 | B. | CH3-CH(CH3)-CH2-CH3 | ||
| C. | CH3-CH2-CH2-CH2-CH2-CH3 | D. | CH3-CH2-CH2-CH2-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com