
科目:高中化学 来源:不详 题型:单选题
| A.乙酸与乙醇的混合液可用分液漏斗进行分离 |
| B.将金属钠在研钵中研成粉末,使钠与水反应的实验更安全 |
| C.钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用 |
| D.用标准盐酸滴定待测NaOH溶液,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
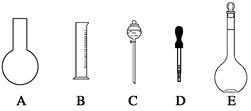
| A.配制一定体积准确浓度的标准溶液 |
| B.量取一定体积的液体 |
| C.测量容量瓶规格以下的任意体积的液体 |
| D.准确稀释某一浓度的溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向盛有少量浓硫酸的量筒中缓慢加入一定量的水并搅拌,可得稀硫酸 |
| B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| C.蒸馏操作时,应将温度计水银球插入液面下 |
| D.称量氢氧化钠固体的质量时,将称量物放在纸片上,并置于托盘天平的左盘,砝码放在托盘天平的右盘 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
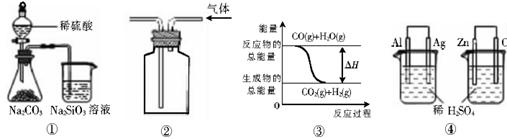
| A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B.用图②所示实验装置排空气法收集CO2气体 |
C.图③表示可逆反应CO(g)+H2O(g) CO2(g)+H2(g)的△H大于0 CO2(g)+H2(g)的△H大于0 |
| D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
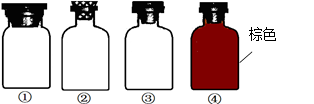
| A.用①瓶盛装浓硝酸 | B.用②瓶盛烧碱溶液 |
| C.用③瓶盛大理石 | D.用④瓶盛浓硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.容量瓶用蒸馏水洗净后,没有干燥即用来配溶液 |
| B.用湿润的pH试纸测量某溶液的pH值 |
| C.容量瓶上只标有所配溶液的体积和刻度 |
| D.在做蒸馏实验时应将温度计的水银球浸没在液体里 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.Fe2(SO4)3 | B.Fe(NO3)3 | C.FeCl3 | D.FeBr3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com