
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 | |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | |||||
| 4 | ⑧ | ⑨ | ⑩ |
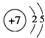 ;⑧为K元素,原子核外有19个电子,有4个电子层,各层电子数为:2、8、8、1,原子结构示意图为:
;⑧为K元素,原子核外有19个电子,有4个电子层,各层电子数为:2、8、8、1,原子结构示意图为: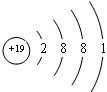 ,故答案为:
,故答案为: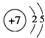 ;
; ;
; ;⑧和⑩形成的化合物KBr,由钾离子与溴离子构成,其电子式为:
;⑧和⑩形成的化合物KBr,由钾离子与溴离子构成,其电子式为: ,
, ;
; ;
;

科目:高中化学 来源: 题型:
| A、2.7g金属铝变为铝离子时失去的电子数为0.3NA |
| B、1mol HCl气体中的粒子数与0.5mol/L盐酸中溶质粒子数相等 |
| C、在标准状况下,22.4L CH4与18g H2O所含有电子不等 |
| D、22.4L的CO气体与1mol N2所含的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯的产量是衡量一个国家石油发展水平的标志 |
| B、减少燃煤的使用可以减少有毒有害气体对环境的污染 |
| C、将废弃塑料制品用化学方法加工成防水涂料或汽油 |
| D、35%--60%甲醛溶液俗称为福尔马林,具有很好的防腐杀菌效果,可用来浸泡海产品来起到保鲜效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 碱 | 酸 | 盐 | 酸性氧化物 | |
| A | 纯碱 | 盐酸 | 胆矾 | 二氧化硫 |
| B | 烧碱 | 硫酸 | 食盐 | 一氧化碳 |
| C | 苛性钠 | 醋酸 | 石灰石 | 水 |
| D | 苛性钠 | 碳酸 | 碳酸镁 | 三氧化硫 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COONa溶液中 c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B、(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| C、Na2CO3溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、NaHS溶液中:c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ③ | ④ | ||||||
| 3 | ② | ⑤ | ⑥ | |||||
| 4 | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用回答下列问题:
如表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用回答下列问题: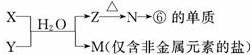
查看答案和解析>>
科目:高中化学 来源: 题型:
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
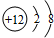 ,该离子的符号为
,该离子的符号为查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
4 | ⑩ | ? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com