
 ,故答案为:
,故答案为: ;
;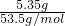 =0.1mol,n(NH3)=
=0.1mol,n(NH3)=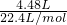 =0.2mol,由原子守恒及质量守恒,则A+0.1molNH4Cl→0.1molNaCl+0.2molNH3,
=0.2mol,由原子守恒及质量守恒,则A+0.1molNH4Cl→0.1molNaCl+0.2molNH3,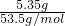 =0.1mol,n(NH3)=
=0.1mol,n(NH3)=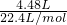 =0.2mol,利用原子守恒及质量守恒确定A,利用反应物与生成物书写化学式.
=0.2mol,利用原子守恒及质量守恒确定A,利用反应物与生成物书写化学式.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?成都模拟)一水硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4?H2O]是一种重要的染料及农药中间体.请回答下列相关问题:
(2012?成都模拟)一水硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4?H2O]是一种重要的染料及农药中间体.请回答下列相关问题:| H | + 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源:2013年浙江省湖州市高考化学二模试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com