
| A. | NH4+、CO32-、K+、Na+ | B. | Na+、Ba2+、Cl-、HCO32- | ||
| C. | NO3-、Cu2+、K+、SO42- | D. | NO3-、K+、CO32-、OH- |
分析 加入铝粉能放出氢气的无色溶液,为非氧化性酸或强碱溶液,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
解答 解:加入铝粉能放出氢气的无色溶液,为非氧化性酸或强碱溶液,
A.酸性溶液中不能大量存在CO32-,碱性溶液中不能大量存在NH4+,故A不选;
B.碱溶液中不能大量存在HCO3-,酸溶液中不能大量存在HCO3-,故B不选;
C.Cu2+为蓝色溶液,故C不选;
D.碱性溶液中该组离子之间不反应,可大量共存,且离子均为无色,故D选.
故选:D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Q>Q1>2Q2 | B. | Q2<Q1<2Q2 | C. | Q=Q1>Q2 | D. | Q1=2Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
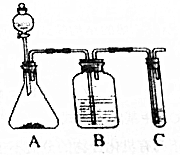 利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.
利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.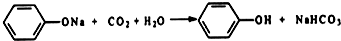 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
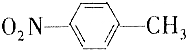 和
和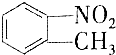 的一些物理性质如下表所示:
的一些物理性质如下表所示:| 物质 | 熔点 | 沸点 | 密度 | 水溶性 |
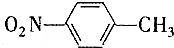 | -10℃ | 212℃ | 1.1622g/cm3 | 不溶于水 |
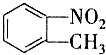 | 54℃ | 238℃ | 1.1581g/cm3 | 不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液的中水电离出的c(H+)=10-amol/L | |
| B. | 加水稀释,醋酸钠的水解程度增大,水的电离程度也增大 | |
| C. | 加入盐酸,pH=7时,有c(Cl-)=c(CH3COOH) | |
| D. | 向溶液中加入醋酸呈酸性,则一定是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6O | B. | CH3O | C. | C4H12O2 | D. | C5H10O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
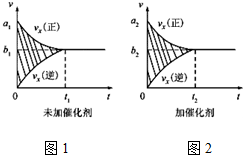
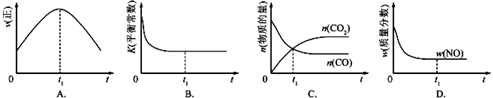
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com