
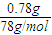 =0.01mol,
=0.01mol,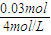 =0.0075L,即7.5mL;
=0.0075L,即7.5mL;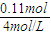 =0.0275L,即27.5mL;
=0.0275L,即27.5mL;

 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3mL | B.9.5mL | C.15mL | D.27.5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下进行甲、乙、丙三组实验:三组各取30毫升同浓度的盐酸溶液,加入同一种镁铝合金粉未,产生气体,有关数据列表如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量(毫克) | 255 | 385 | 459 |
生成气体体积(毫升) | 280 | 336 | 336 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com