
Ⅰ实验室进行实验①制乙烯②制溴苯③石油分馏④银镜反应
(1)不需要加热的有 ;
(2)需要水浴的有 ;
(3)需要加碎瓷片的有 ;
(4)反应中必须加入浓H2SO4的有 ;(填序号)
Ⅱ现有:A.(CH3)3CCl;B.(CH3)3CCH2Cl;C.(CH3)2CHCl;D.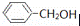 四种有机物
四种有机物
(1)能水解生成醇的是 ;(填字母)
(2)不能消去成烯的是 ;(填字母)
(3)D与甲酸发生酯化反应的产物是 .(写分子式)
考点:
有机物的结构和性质;有机物分子中的官能团及其结构.
专题:
有机反应.
分析:
I.(1)不需要加热是指常温下即可进行的反应;
(2)水浴加热的反应条件是温度控制在高于常温且低于100℃之间的温度范围内;
(3)对混合物液体加热时,为防止暴沸要加入碎瓷片;
(4)浓硫酸在不同反应中可作为反应物或作为催化剂;
II.(1)卤代烃水解可生成醇;
(2)与﹣Cl或﹣OH相连C的邻位C上有H可发生消去反应;
(3)D与甲酸发生酯化反应,生成甲酸苯甲酯和水.
解答:
解:I.(1)苯和液溴在催化剂作用下常温下就剧烈反应,故不需要加热,故答案为:②;
(2)含醛基物质的银镜反应,需要的温度介于水浴加热温度范围之内,需用水浴加热,故答案为:④;
(3)浓硫酸跟乙醇反应制乙烯、石油的蒸馏试验及乙酸乙酯的制取中均是对混合液体加热的,为防止液体暴沸,常需加少量碎瓷片,故答案为:①③;
(4)浓硫酸跟乙醇反应制乙烯,浓硫酸都起催化剂和脱水的作用,大大加快了反应速率,故答案为:①;
II(1)卤代烃水解可生成醇,A B、C均符合,故答案为:ABC;
(2)B、D中与﹣Cl或﹣OH相连C的邻位C上没有H,不能发生消去反应,故答案为:BD;
(3)D与甲酸发生酯化反应,生成甲酸苯甲酯和水,产物的分别为C6H5CH2OOCH、H2O,分子式分别为C8H8O2、H2O,故答案为:C8H8O2、H2O.
点评:
本题考查有机物的结构与性质,为高频考点,把握常见有机化学实验中的反应条件以及温度的要求、官能团与性质的关系为解答的关键,注意相关知识的积累,题目难度不大.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
下列叙述正确的是( )
①久置于空气中的氢氧化钠溶液,加盐酸时有气体产生
②浓硫酸可用于干燥氨气、二氧化氮气体
③SiO2和CO2都是酸性氧化物,都能与强碱溶液反应,但不能与任何酸反应
④玻璃、水泥、水晶项链都是硅酸盐制品
⑤蔗糖炭化的演示实验中,浓硫酸既体现了其强氧化性又体现了其脱水性.
|
| A. | ①④⑤ | B. | ①⑤ | C. | ②③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法中,错误的是( )
|
| A. | 乙烯和苯都能与溴水反应 |
|
| B. | CaC2的电子式为 |
|
| C. | 常用质谱法进行有机物相对分子质量的测定 |
|
| D. | 乙醇的结构简式为:C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应2FeCl3+Cu=2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A. 烧杯中有铜无铁 B. 烧杯中铁、铜都无
C. 烧杯中铁、铜都有 D. 烧杯中有铁无铜
查看答案和解析>>
科目:高中化学 来源: 题型:
若原子核外电子的排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第三层电子数不超过15个,而各电子层电子的最大容量仍为2n2,则元素周期表中第三、第四、第五周期含有的元素分别有( )
A. 5种、10种、15种 B. 8种、18种、18种
C. 8种、10种、15种 D. 9种、10种、15种
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液只含有Na+,Al3+,Cl﹣,SO42﹣四种离子,已知Na+,Al3+,Cl﹣的个数比为3:2:1.则溶液中Al3+与SO42﹣离子的个数比为( )
A. 1:2 B. 1:4 C. 3:4 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
在100℃时,将0.40mol的二氧化氮气体充入2L真空的密闭容器中,每隔一段时间就对该容器内的物质进行分析,得到数据如表所示:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为 mol•L﹣1•s﹣1.
(2)n3 n4(填“>”、“<”或“=”),该反应的平衡常数为 (保留小数点后一位).
(3)若在相同情况下,最初向该容器中充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是 mol•L﹣1,假设在80s时达到平衡,请在如图中画出并标明该条件下此反应中N2O4和NO2的浓度随时间变化的曲线.
(4)达到平衡后,如升高温度,气体颜色会变深,则升高温度后,反应2NO2(g)⇌Ν2O4(g)的平衡常数将 (填“增大”、“减小”或“不变”).
(5)达到平衡后,如向该密闭容器中再充入0.32mol氦气,并把容器体积扩大为4L,则平衡将 (填“向左移动”、“向右移动”或“不移动”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com