
| A. | ②④ | B. | ②③ | C. | ①③ | D. | ①④ |
分析 混合液恰好完全反应,生成产物为Fe(NO3)3与H2SO4的混合物,①从质量守恒角度分析:反应中未被还原的硝酸转化为硝酸铁,根据Fe元素守恒可计算出未被还原的硝酸的物质的量,再根据m=nM计算出其质量;
②从氧化还原反应中电子守恒角度分析:在反应中铁元素的化合价从+2价升高到+3价,S元素的化合价从-2价升高到+6价,结合题中水解可计算出转移电子的物质的量,然后根据电子守恒计算出被还原的硝酸,最后根据硝酸总的量可计算出未被还原的硝酸的物质的量.
解答 解:反应中未被还原的硝酸转化为硝酸铁,则根据铁原子守恒可知硝酸铁的物质的量是(a+b)mol,则未被还原的硝酸为3(a+b)mol,其质量是3(a+b)mol×63g/mol,故①错误、②正确;
在反应中铁元素的化合价从+2价升高到+3价,S元素的化合价从-2价升高到+6价,所以还原剂一共失去电子的物质的量是:amol+bmol+8amol=9amol+bmol,则被还原的硝酸是$\frac{9a+b}{3}$mol,参加反应的硝酸是cV,则未被还原的硝酸是(Vc-$\frac{9a+b}{3}$)mol=(Vc-3a-$\frac{b}{3}$)mol,故③错误、④正确;
故选A.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
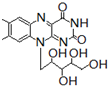
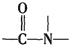 +H2O$→_{△}^{H+}$
+H2O$→_{△}^{H+}$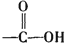 +
+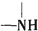 ,有关核黄素的下列说法中,正确的是( )
,有关核黄素的下列说法中,正确的是( )| A. | 该物质属于有机高分子 | B. | 不能发生酯化反应 | ||
| C. | 不能与氢气发生加成反应 | D. | 酸性条件下加热水解,有CO2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
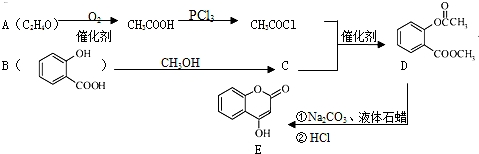
 .
. .
.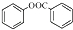 )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下:
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子式为C7H16的烷烃,含有3个甲基的同分异构体有2种 | |
| B. | 分子式为C7H12O4,其中只含二个-COOCH3基团的同分异构体(不考虑手性异构)共有4种 | |
| C. | 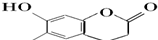 芥子醇的结构简式如图该分子中有5种官能团 芥子醇的结构简式如图该分子中有5种官能团 | |
| D. | 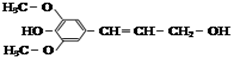 化合物如图能使酸性高锰酸钾溶液褪色,且1mol最多可与4mol氢气发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g CH4所含原子数目为NA | |
| B. | 1mol•L-1 NaCl溶液含有NA个Na+ | |
| C. | 常温常压下,22.4L CO2中含有NA个CO2分子 | |
| D. | 2.4g Mg与足量盐酸反应转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(F-)>c(OH-)>c(HCN)>c(HF) | B. | c(F-)+c(HF)>c(CN-)+c(HCN) | ||
| C. | c(OH-)>c(F-)>c(CN-)>c(H+) | D. | c(OH-)>c(HF)>c(HCN)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
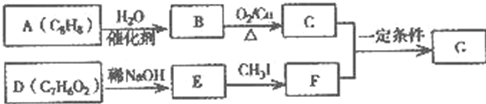

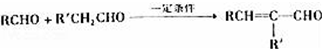
 .
. .
.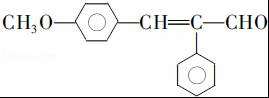 .
.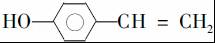 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
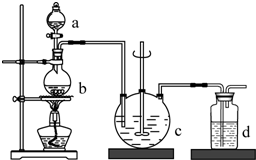 硫代硫酸钠(Na2S2O3),俗名海波、大苏打.通常为无色晶体,易溶于水,难溶于酒精,受热、遇酸易分解.医学上用于抢救氰化物中毒,常用于碘化法的测量.工业制备的反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,实验室模拟该工业过程的装置如图所示,回答下列问题:
硫代硫酸钠(Na2S2O3),俗名海波、大苏打.通常为无色晶体,易溶于水,难溶于酒精,受热、遇酸易分解.医学上用于抢救氰化物中毒,常用于碘化法的测量.工业制备的反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,实验室模拟该工业过程的装置如图所示,回答下列问题:| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com