
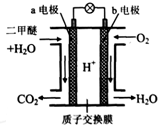
 二甲醚是一种绿色、可再生的新能源.如图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )
二甲醚是一种绿色、可再生的新能源.如图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )| A、a电极为该电池负极 |
| B、当有0.4mol电子转移时,b极消耗O2 2.24L |
| C、电池工作时,a电极反应式:CH3OCH3-12e-+3H2O→2CO2↑+12H+ |
| D、电池工作时,燃料电池内部H+从a电极移向b电极 |


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
| A、SO2通入品红溶液,溶液褪色的原理与SO2通入溴水后褪色的原理相同 |
| B、浓硫酸具有强氧化性,稀硫酸不具有氧化性 |
| C、用浓FeCl3溶液和NaOH溶液混合制备Fe(OH)3胶体 |
| D、明矾和漂白粉常用于自来水的净化和杀菌消毒,但二者的作用原理不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用使铁钝化的方法来减缓铁的腐蚀 |
| B、除去CO气体中的少量氧气可让气体通过加热的铜网 |
| C、不论将铝箔加热到什么样的温度均是只熔化而不滴落下来 |
| D、等质量的铝与盐酸或氢氧化钠溶液反应时产生的氢气体积一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 | ||
| B、铁片镀锌时,铁片与外电源的正极相连 | ||
| C、NaClO溶液中通入少量CO2,ClO-水解程度增大,溶液碱性增强 | ||
D、t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
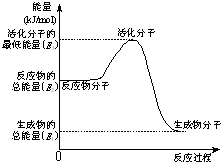 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是| 1 |
| 2 |
| A、上述图示的反应为吸热反应 |
| B、图中的能量变化如图所示,则Q=E3-E1 |
| C、H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收热量 |
| D、根据①②推知:在25℃,101kPa时,1mol CH3OH(g)完全燃烧生成CO2和H2O放出的热量应676.7kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、371.6 |
| B、355.6 |
| C、333.6 |
| D、332.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氨和肼(N2H4)是氮的两种常见氢化物,在科学技术和生产中有重要的应用.
氨和肼(N2H4)是氮的两种常见氢化物,在科学技术和生产中有重要的应用.| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 7.1 | 50.6 | 3.8 |
| n(NH3) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素W与元素X形成的含有共价键的化合物只有一种 |
| B、元素X的单质与元素Y的单质反应时,反应条件不同,产物也不同 |
| C、元素Y与元素W可以原子个数比为1:1的化合物甲,且甲与水反应有气体产生 |
| D、元素Z的单质与元素W.Y的单质都能反应,且反应中Z的单质都做氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com