
| A. | 0.5 mol•L-1 NaOH溶液中Na+数为0.5NA | |
| B. | 标准状况下,22.4 L四氯化碳含有的分子数为NA | |
| C. | 常温常压下,1mol Na2O2与足量CO2反应,电子转移数为NA | |
| D. | 标准状况下,16 g氧气臭氧的混合气体所含原子数一定为2NA |
分析 A、溶液体积不明确;
B、标况下四氯化碳为液态;
C、过氧化钠与二氧化碳的反应为歧化反应;
D、氧气和臭氧均由氧原子构成.
解答 解:A、溶液体积不明确,故溶液中的钠离子的个数无法计算,故A错误;
B、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量,故B错误;
C、过氧化钠与二氧化碳的反应为歧化反应,过氧化钠中氧元素中的价态由-1价变为0价,故1mol过氧化钠反应转移1mol电子即NA个,故C正确;
D、氧气和臭氧均由氧原子构成,故16g混合物中含有的氧原子的物质的量为n=$\frac{16g}{16g/mol}$=1mol,个数为NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠在用小刀切割后,剩余的钠应放回煤油中 | |
| B. | 焰色反应实验前,铂丝应先用盐酸洗涤后灼烧至无色,焰色反应是一种物理变化 | |
| C. | 实验室制备氢氧化亚铁时,滴加氢氧化钠溶液的胶头滴管伸入液面下 | |
| D. | 将烧碱溶液保存在磨口的细口玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A气体是NH3,B气体是CO2 | |
| B. | 侯氏制碱法的工艺过程应用了物质溶解度的差异 | |
| C. | 第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒 | |
| D. | 第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在化学研究领域,经常需要对一些物质进行性质的确定.如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:
在化学研究领域,经常需要对一些物质进行性质的确定.如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 84% | B. | 50% | C. | 16% | D. | 39% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [H+] | B. | Ka(HF) | C. | $\frac{[{F}^{-}]}{[{H}^{+}]}$ | D. | $\frac{[{H}^{+}]}{[HF]}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C7H8O,且含苯环的有机化合物有4种 | |
| B. | 乙醇能使酸性高锰酸钾溶液褪色 | |
| C. | 向无水乙醇中加入浓H2SO4,加热至170℃,产生的使酸性KMnO4溶液褪色的气体只是乙烯 | |
| D. | 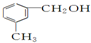 遇FeCl3溶液可显紫色 遇FeCl3溶液可显紫色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com