
某校化学兴趣小组利用在加热条件下浓盐酸与二氧化锰的反应
来制取并收集氯气,实验装置如图所示。
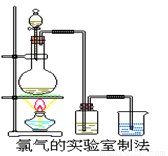
⑴写出该反应的化学方程式:
⑵上述反应中,盐酸表现出性质是 。
(3)实验开始时,某学生对实验装置进行了气密性检查,
方法是
(4)兴趣小组的同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为错误的是 。
A.NaOH 溶液 B.Na2CO3溶液 C.浓硫酸
(5)实验室取含氯化氢14.6g的浓盐酸与足量的二氧化锰反应,可以收集到标准状况下的氯气体积 (填大于、小于或等于)2.24L,原因是
⑴ MnO2+4HCl(浓)=△=MnCl2+2H2O+Cl2↑ (2分)
⑵酸性 还原性 (2分)
(3)关闭分液漏斗的活塞,用酒精灯微热烧瓶时可以看到插入烧杯中的导管口有气泡,停止加热后插入烧杯中的导管中形成液柱,说明气密性良好。(2分)
(4)C (2分)
(5)小于(2分) 随着反应的进行,氯化氢不断消耗及挥发,使浓盐酸变成稀盐酸,反应停止,氯化氢不能反应完。(2分)
【解析】
试题分析:⑴实验室采用浓盐酸在二氧化锰的催化加热条件下来制备氯气,该反应的化学方程式为:MnO2+4HCl(浓)=△=MnCl2+2H2O+Cl2↑,⑵从这条反应方程式可以看出盐酸所表现的性质是酸性和还原性;(3)实验开始时,必须检验该装置的气密性,其可以采用的方法为:关闭分液漏斗的活塞,用酒精灯微热烧瓶时可以看到插入烧杯中的导管口有气泡,停止加热后插入烧杯中的导管中形成液柱,说明气密性良好;(4)因为浓硫酸并不会吸收氯气,故不能用浓硫酸来吸收氯气,故本题的答案选择C;(5)实验室取含氯化氢14.6g的浓盐酸与足量的二氧化锰反应,可以收集到标准状况下的氯气的体积小于2.24L,这是随着反应的进行,氯化氢不断消耗及挥发,使浓盐酸变成稀盐酸,反应停止,氯化氢不能反应完。
考点:氯气的制备
点评:本题考查了氯气的制备实验,该实验是高中的经典实验之一,本题考查的都是学生比较熟悉的知识点,该题难度中等。


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| m-c |
| m |
| m-c |
| m |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol?L-1 H2SO4至溶液显酸性,然后将所得溶液分置于A、B试管中. | / |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省涡阳四中高一下第二次(5月)质量检测化学卷(带解析) 题型:实验题
某校化学兴趣小组利用在加热条件下浓盐酸与二氧化锰的反应 来制取并收集氯气,实验装置如图所示。
来制取并收集氯气,实验装置如图所示。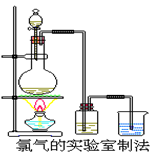

 ⑴写出该反应的化学方程式:
⑴写出该反应的化学方程式:  ⑵上述反应中,盐酸表现出性质是 。
⑵上述反应中,盐酸表现出性质是 。 (3)实验开始时,某学生对实验装置进行了气密性检查,
(3)实验开始时,某学生对实验装置进行了气密性检查, 方法是
方法是 
 (4)兴趣小组的同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为错误的是 。
(4)兴趣小组的同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为错误的是 。 A.NaOH 溶液 B.Na2CO3溶液 C.浓硫酸
A.NaOH 溶液 B.Na2CO3溶液 C.浓硫酸 (5)实验室取含氯化氢14.6g的浓盐酸与足量的二氧化锰反应,可以收集到标准状况下的氯气体积 (填大于、小于或等于)2.24L,原因是
(5)实验室取含氯化氢14.6g的浓盐酸与足量的二氧化锰反应,可以收集到标准状况下的氯气体积 (填大于、小于或等于)2.24L,原因是 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com