
【题目】实验室欲用NaOH固体配制1.0mol·L-1 的NaOH溶液 240mL
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移⑥洗涤 ⑦定容 ⑧冷却
本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、还有_________.
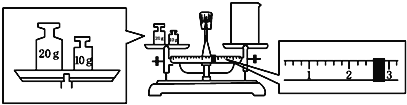
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.烧杯的实际质量为__________g,要完成本实验该同学应称出__________gNaOH.
(3)使用容量瓶前必须进行的一步操作是_________________________________.
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是________________.
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线.
【答案】 250mL容量瓶 27.4 10.0 查漏 ④⑤
【解析】(1)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶、贴标签,用到的仪器依次为:托盘天平、药匙、玻璃棒、烧杯、容量瓶和胶头滴管,要配制1.0molL-1的NaOH溶液240mL,应选择250mL容量瓶,所以还缺少的仪器:250mL容量瓶;故答案为:250mL容量瓶;
(2)依据天平称量固体原理结合图像可知:砝码的质量=烧杯质量 +游码的质量,左盘中砝码为20g,10g,游码质量2.6g,所以烧杯的实际质量为20g+10g-2.6g=27.4g;配制1.0molL-1的NaOH溶液240mL,应选择250mL容量瓶,配制250mL溶液,需要氢氧化钠质量m=1.0mol/L×40g/mol×0.25L=10.0g;故答案为:27.4;10.0;
(3)容量瓶带有活塞,使用过程中需要上下颠倒,所以使用前应检查是否漏水,故答案为:查漏;
(4)①没有洗涤烧杯和玻璃棒,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故不选;②转移溶液时不慎有少量洒到容量瓶外面,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故不选;③容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故不选;④定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故选;⑤未冷却到室温就将溶液转移到容量瓶并定容,冷却后,液面下降,溶液体积偏小,溶液浓度偏高,故选;⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故不选;故答案为:④⑤。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铝常温下与浓硝酸不发生反应
B. Fe(OH)2呈红棕色,难溶于水
C. 水玻璃浸泡过的木材能防火
D. 只经过物理变化即可由海水制得Na、Mg、Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 乙醇和乙酸都是常用调味品的主要成分
B. 乙醇和乙酸的沸点和熔点都比C2H6和C2H4的沸点和熔点高
C. 乙酸和乙醇之间能发生酯化反应
D. 乙醇 和乙酸都能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-18,下列说法正确的是
A.该溶液可能pH=5B.该溶液的pH一定是9
C.该溶液的pH可能是7D.不会有这样的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是一种有效的抗疟药。常温下,青蒿素为无色针状晶体,难溶于水,易溶于有机溶剂,熔点为156~157℃。提取青蒿素的方法之一是乙醚浸取法,提取流程如下:

请回答下列问题:
(l)对青蒿进行破碎的目的是__________________。
(2)操作I用到的玻璃仪器是__________,操作Ⅱ的名称是_______。
(3)用下列实验装置测定青蒿素的化学式,将28.2g青蒿素放在燃烧管C中充分燃烧:

① 仪器各接口的连接顺序从左到右依次为_______(每个装置限用一次)。A装置中发生的化学反应方程式为_________________。
② 装置C中CuO的作用是_________________。
③ 装置D中的试剂为_________________。
④ 已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验.测量数据如下表:
装置质量 | 实验前/g | 实验后/g |
B | 22.6 | 42.4 |
E(不含干燥管) | 80.2 | 146.2 |
则青蒿素的最简式为__________。
(4)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH 、酚酞的水溶液中,青蒿素的溶解度较小,加热并搅拌,青蒿素的溶解度增大,且溶液红色变浅,与青蒿素化学性质相似的物质是______(填字母代号)。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铁及其氧化物是日常生活生产中应用广泛的材料。请回答下列问题:
(l)基态铁原子的价电子轨道表达式为__________。
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+_______Fe2+(填“大于”或“小于”),原因是________________。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,NH4+的结构式为______(标出配位键),空间构型为_________,其中氮原子的杂化方式为_______;与ClO4-互为等电子体的分子或离子有__________(任写两种)。
(4)金属铁晶体原子采用________堆积.铁晶体的空间利用率为______(用含π的式子表示)。
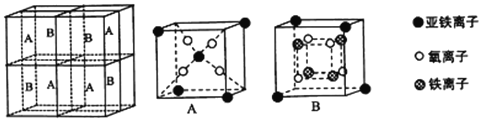
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该权化物中Fe2+、Fe3+、O2-的个数比为_______(填最简整数比);己知该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则品胞参数a 为_______nm(用含d 和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配制稀硫酸时,先将浓硫酸加入烧杯中,后倒入蒸馏水(______)
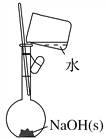
(2)称取2.0 g NaOH固体,可先在托盘上各放一张滤纸,然后在右盘上添加2 g砝码,左盘上添加NaOH固体(_______)
(3)按照下图操作,配制一定浓度的NaCl溶液(_____)

(4)按照下图操作,配制0.10 mol·L-1 NaOH溶液(______)
(5)配制溶液定容时,俯视容量瓶刻度会使溶液浓度偏高(_______)
(6)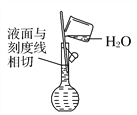 配制溶液(_______)
配制溶液(_______)
(7)因为Ca(OH)2能制成澄清石灰水,所以可配制2.0 mol·L-1的Ca(OH)2溶液(_____)
(8)配制0.100 0 mol·L-1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流(_______)
(9)用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小(________)
(10)用固体NaCl配制0.5 mol·L-1的溶液,所用的仪器有:烧杯、玻璃棒、胶头滴管、容量瓶(_______)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4L乙醇的分子数约为NA
B. 14gN2和CO的混合气体中所含原子数为NA
C. 48gO2和O3的混合气体中所含的原子数为3NA
D. 1mo1·L-1的MgC12溶液中,C1-离子的数目为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:
CO(NH2)2+2NaOH+NaClO==Na2CO3+N2H4·H2O+NaCl
据此,某学生设计了下列实验.
【制备NaClO溶液】实验装置如下图左图所示(部分夹持装置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3

(1)配制30 %NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_______________;Ⅱ中玻璃管a的作用为____________;为了提高NaClO的产率,需对I中产生的Cl2进行净化,所用试剂是________________;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的___________________
【制取水合肼】实验装置如上图右图所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2 H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式____________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品,B装置的名称是______________
【测定肼的含量】
(4)称取馏分0.3000 g,加水配成20.0 mL溶液,一定条件下用0.1500 mol.L-1 的I2溶液滴定。
已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。
①滴定时,可以选用的指示剂为____________;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com