
以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是( )
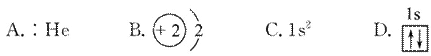
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
已知25℃时BaSO4饱和溶液中存在BaSO4(s) Ba2+(aq)+S
Ba2+(aq)+S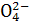 (aq),Ksp=1.102 5×10-10,下列有关BaSO4的溶度积和溶解平衡的叙述中正确的是( )
(aq),Ksp=1.102 5×10-10,下列有关BaSO4的溶度积和溶解平衡的叙述中正确的是( )
A.25℃时,向c(S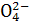 )=1.05×10-5mol·L-1的BaSO4饱和溶液中,加入BaSO4固体,
)=1.05×10-5mol·L-1的BaSO4饱和溶液中,加入BaSO4固体,
c(S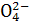 )增大
)增大
B.向该饱和溶液中加入Ba(NO3)2固体,则BaSO4的溶度积常数增大
C.向该饱和溶液中加入Na2SO4固体,则该溶液中c(Ba2+)>c(S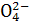 )
)
D.向该饱和溶液中加入BaCl2固体,则该溶液中c(S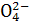 )减小
)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
蚂蚁会分泌一种信息素(化学式为C10H18O),下列说法正确的是( )
①该信息素由碳、氢、 氧三种元素组成 ;
氧三种元素组成 ;
②该信息素中碳、氢、氧三种元素的质量比为10:18:1;
③该信息素是由多种原子构成的化合物;
④该信息素的一个分子中含有29个原子。
A.①④ B.②③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验:
[实验一] 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题。
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、 和 。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液 的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为 (保留小数点后四位)。
[实验二]探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度(mol·L-1) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是: 。
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将 (填“增大”“减小”或“不变”)。
[实验三] 探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项表述中,两个粒子一定不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布为2s22p5的原子
C.M层全充满而N层排布为4s2的原子和核外电子排布为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数1/5的原子和最外层电子排布为4s24p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
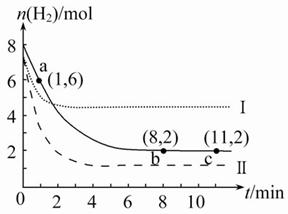 T ℃时,将6 mol CO2和8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)
T ℃时,将6 mol CO2和8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是( )
CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是( )
A.反应开始至a点时v(H2)=1 mol·L-1·min-1
B.若曲线Ⅰ对应的条件改变是升温,则该反应ΔH>0
C.曲线Ⅱ对应的条件改变是降低压强
D.T ℃时,该反应的化学平衡常数为0.125
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是将手持技术用于未知浓度盐酸滴定20.00 mL 0.1 mol·L-1NaOH溶液,测定盐酸浓度的实验(盐酸的滴定速率为0.098 mL·s-1)。下列有关说法中不正确的是( )
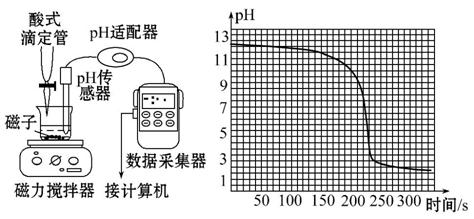
A.此中和滴定的反应原理是:H++OH-====H2O
B.H+与OH-反应生成水使溶液的pH发生变化,用传感器能精确测定出来
C.与传统中和滴定比较,可以避免酸碱指示剂对终点准确判断的难题
D.根据图中计算机绘制的酸碱中和滴定曲线可知:250 s时达到滴定终点
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需配制一种仅含四种离子(不包括水电离出的离子)的无色混合溶液,且在混合溶液中四种离子的物质的量浓度均为1 mol·L-1。下面四个选项中能达到此目的的是( )
A.Na+、K+、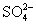 、Cl-
、Cl-
B.Cu2+、K+、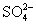 、
、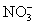
C.H+、K+、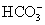 、Cl-
、Cl-
D.Mg2+、Na+、Cl-、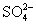
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com