

 C B. 3A+2B
C B. 3A+2B 2C
2C  2C D .A+3B
2C D .A+3B C
C科目:高中化学 来源:不详 题型:填空题
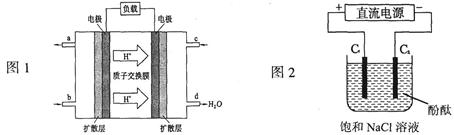
 CH3OH(g),现模拟并分析该反应:
CH3OH(g),现模拟并分析该反应: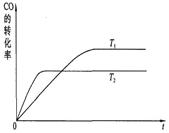
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 mC+2D,经5min后达到平衡,此时C为0.2mol。又知在此反应时间D的平均反应速率为0.1mol·L-1·min-1,以下结论正确的是 ( )
mC+2D,经5min后达到平衡,此时C为0.2mol。又知在此反应时间D的平均反应速率为0.1mol·L-1·min-1,以下结论正确的是 ( )查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O Cr3+ (aq)+3OH—(aq)
Cr3+ (aq)+3OH—(aq)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


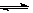 2CO(g),K1
2CO(g),K1 H2(g)+CO2(g),K2
H2(g)+CO2(g),K2 CO(g)+H2(g),K3
CO(g)+H2(g),K3 H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 2NO2(g);△H=Q(Q>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。
2NO2(g);△H=Q(Q>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。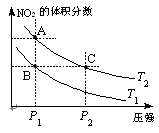
 2N2(g) + 3H2O(g)
2N2(g) + 3H2O(g)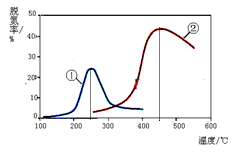
 以下说法正确的是(注:脱氮率即氮氧化物转化率)
以下说法正确的是(注:脱氮率即氮氧化物转化率)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g) + R(g),反应平衡时,则知X 和Y 的转化率分别为30%和60%,
2Z(g) + R(g),反应平衡时,则知X 和Y 的转化率分别为30%和60%, | A.1 | B.2 | C.3 | D.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.可逆反应的特征是正反应速率和逆反应速率相等 |
| B.对已达到化学平衡的反应仅改变浓度,若平衡移动,则平衡常数(K)一定不变。 |
| C.电镀时应把镀件置放电解槽的阳极。 |
| D.电解AlCl3来制取金属铝。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO2(g)+N2(g),己知该反应速率极慢,570K时平衡常数为1×1059。下列说法正确的是 ( )
CO2(g)+N2(g),己知该反应速率极慢,570K时平衡常数为1×1059。下列说法正确的是 ( )| A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B.提高尾气净化效率的常用方法是升高温度 |
| C.提高尾气净化效率的最佳途径是研制高效催化剂 |
| D.570K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应:2CO(g)+2NO(g) |
| B.0.1mol/L NH4C1溶液加蒸馏水稀释,溶液的pH不断减小 |
| C.铅蓄电池放电时,正极和负极均有硫酸铅生成 |
D.反应:2A(g) B(g)+2C(g),增大压强反应速率加快,A的转化率减小 B(g)+2C(g),增大压强反应速率加快,A的转化率减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com