
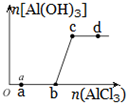 向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系示意如图所示.则的下列说法不正确的是( )
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系示意如图所示.则的下列说法不正确的是( )| A. | a点对应的溶液中加入MgCl2无明显现象 | |
| B. | b点对应的溶液是NaAlO2溶液 | |
| C. | c点对应的溶液中c(Na+)=c(Cl-) | |
| D. | d点对应的溶液呈酸性 |
分析 向一定量的NaOH溶液中逐滴加入AlCl3溶液,从0到b,氢氧化钠过量,反应生成偏铝酸钠:4NaOH+AlCl3=NaAlO2+2H2O+3NaCl,没有沉淀生成,当NaOH完全反应,即从b点开始偏铝酸钠与氯化铝反应生成氢氧化铝沉淀,其反应为3NaAlO2+AlCl3+6H2O=3NaCl+4Al(OH)3↓,据此分析.
解答 解:向一定量的NaOH溶液中逐滴加入AlCl3溶液,从0到b,氢氧化钠过量,反应生成偏铝酸钠:4NaOH+AlCl3=NaAlO2+2H2O+3NaCl,没有沉淀生成,当NaOH完全反应,即从b点开始偏铝酸钠与氯化铝反应生成氢氧化铝沉淀,其反应为3NaAlO2+AlCl3+6H2O=3NaCl+4Al(OH)3↓;
A.a点对应的溶液中,NaOH过量,溶液中存在NaOH,加入MgCl2会生成氢氧化镁沉淀,故A错误;
B.b点NaOH恰好完全反应生成NaAlO2和NaCl,故B错误;
C.c点偏铝酸钠与氯化铝恰好反应生成氢氧化铝沉淀,其反应为3NaAlO2+AlCl3+6H2O=3NaCl+4Al(OH)3↓,所以c点对应的溶液中c(Na+)=c(Cl-),故C正确;
D.c点偏铝酸钠与氯化铝恰好反应生成氢氧化铝沉淀,d点AlCl3溶液过量,AlCl3在溶液中水解显酸性,所以d点对应的溶液呈酸性,故D正确.
故选B.
点评 本题考查离子反应,题目难度中等,明确图象中各点对应溶质组成为解答关键,注意掌握离子反应发生条件,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | H2S2O3溶液显弱酸性的原因是:H2S2O3?H++HS2O3- | |
| B. | Na2S2O3溶液显碱性的原因是:S2O32-+2 H2O?H2S2O3+2OH- | |
| C. | Na2S2O3和AgBr反应的离子方程式是:2S2O32-+AgBr?Ag(S2O3)23-+Br- | |
| D. | 定影不能在酸性较强的溶液中进行的原因是:S2O32-+2H+=S↓+SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减小反应物浓度,可减小反应物分子中的活化分子百分数,使有效碰撞次数减小 | |
| B. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 | |
| C. | 有气体参加的化学反应,若增大压强(即缩小反应容器的容积),可增加活化分子的百分数,从而使反应速率增大 | |
| D. | 催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验淀粉是否完全水解:取少量水解液于试管中,加入过量氢氧化钠溶液和新制Cu(OH)2悬浊液,加热至沸腾,看是否有砖红色沉淀生成 | |
| B. | 提纯混有少量CaCl2的NaCl固体:将固体配成溶液,加入稍过量Na2CO3溶液至沉淀完全,过滤,再向滤液中加入稍过量盐酸,蒸发结晶 | |
| C. | 制取少量乙酸乙酯:向试管中加入浓硫酸,再加入无水乙醇,冷却后加入冰醋酸,加热,将生成的蒸气导至盛有氢氧化钠溶液的试管中 | |
| D. | 验证炭与浓硫酸反应产生的CO2:将炭与浓硫酸反应生成的气体通入盛有澄清石灰水的试管中,观察是否有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3?+2H2O+CO32- | |
| B. | FeCl3溶液与HI溶液反应:2Fe3++2HI═2Fe2++I2+2H+ | |
| C. | 向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-═Ag2S↓+2Cl- | |
| D. | 石灰石与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | HClO有强氧化性,体现漂白作用是其褪色 |
| 然后溶液从无色逐渐变为浅绿色 | 溶液中溶解了大量的氯气,体现浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸 | B. | 氢氧化钠 | C. | 无水乙醇 | D. | 石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 硫酸钠溶液与氯化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| C. | 盐酸滴在石灰石上:CaCO3+2H+═H2CO3+Ca2+ | |
| D. | 氧化铜与硫酸混合:Cu2++SO42-═CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe (OH )3;Fe2O3 | B. | Fe (OH)2; FeO、Fe (OH)2 | ||
| C. | Fe (OH)3;Fe3O4 | D. | Fe2O3;Fe (OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com