
| AX | BX | AY | BY |
| pH=7,c(X-)=1mol/L | pH=4 | pH=6 |
分析 AX的溶液pH=7且溶液中c(X-)=1mol/L,说明HX为强酸,AOH为强碱;BX的溶液pH=4,BY的溶液pH=6,溶液呈酸性,说明HY为弱酸,BOH为弱碱,
(1)AOH为强碱,HY为弱酸,AY溶液为强碱弱酸盐,据此判断溶液酸碱性;
(2)溶液酸性越强,稀释相同倍数时溶液的pH变化越大;溶液碱性越弱,pH变化相等时溶液体积变化越大;
(3)根据电荷守恒、物料守恒进行分析;
(4)A2Z若能够水解,由于AOH为强碱,则H2Z为弱酸,Z2-离子在溶液中分步水解,主要以第一步为主.
解答 解:AX的溶液pH=7且溶液中c(X-)=1mol/L,说明HX为强酸,AOH为强碱;BX的溶液pH=4,BY的溶液pH=6,溶液呈酸性,说明HY为弱酸,BOH为弱碱,
(1)AOH为强碱,HY为弱酸,AY溶液为强碱弱酸盐,其溶液的pH大于7,
故答案为:>;
(2)HX为强酸,完全电离;HY为弱酸,在溶液中部分电离,存在电离平衡:HY?H++Y-,将等浓度的HX、HY稀释相同的倍数,pH值变化HX大于HY;AOH为强碱,完全电离;BOH为弱碱,部分电离,存在BOH?B++OH-电离平衡,将等浓度的AOH、BOH稀释相同的倍数,pH值变化AOH大于BOH,所以若将等体积、等pH的AOH、BOH溶液在稀释时pH均下降2,则加水量:AOH<BOH,
故答案为:>;<;
(3)HX强酸,BOH为弱碱,在1mol/L的BX溶液中存在电荷守恒:c(B+)+c(H+)=c(OH-)+c(X-),则c(B+)+c(H+)-c(OH-)=c(X-)=1mol/L;
在1mol/L的AY溶液中,根据物料守恒可得:c(A+)=c(Y-)+c(HY),根据电荷守恒可得:c(Y-)+c(OH-)=c(H+)+c(A+),二者结合可得:c(A+)-c(Y-)=c(HY)=c(OH-)-c(H+),
故答案为:1mol/L;c(HY); c(OH-)-c(H+);
(4)A2Z的水解反应分步进行,主要以第一步为主,其Z2-水解的离子方程式为:Z2-+H2O?HZ-+OH-、HZ-+H2O?H2Z+OH-,
故答案为:Z2-+H2O?HZ-+OH-;HZ-+H2O?H2Z+OH-.
点评 本题考查了弱电解质的电离平衡及其影响、离子浓度大小比较,题目难度中等,明确盐的水解原理为解答关键,注意掌握电荷守恒、物料守恒在判断离子浓度大小中的应用方法.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 对有气体参加的化学反应,通过减小体积增大体系压强,可使单位体积内活化分子数增加,因而反应速率增大 | |
| B. | 升高温度,主要是因为分子运动加剧,碰撞频率提高,因而反应速率增大 | |
| C. | 活化分子之间发生的碰撞一定为有效碰撞 | |
| D. | 加入适宜的催化剂,可使活化能增大,从而加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ),试写出该两步反应对应的化学方程
),试写出该两步反应对应的化学方程 ;
;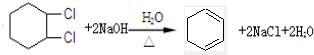 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ⑤ | C. | ③④⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再加入10mL pH=11 NaOH溶液,混合液pH=7 | |
| B. | 醋酸的电离程度增大,c(H+)亦增大 | |
| C. | 溶液中导电粒子的数目增加,导电性增强 | |
| D. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•(O{H}^{-})}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t(秒) | 0 | 500 | 1000 |
| N2O5浓度mol•L-1 | 5.00 | 3.50 | 2.42 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量不是1mol | B. | 含的氧原子个数为1mol | ||
| C. | 质子数是2mol | D. | 氧分子个数为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火,立即用泡沫灭火器灭火 | |
| B. | 在气体发生装置上直接点燃甲烷气体时,必须先检验甲烷的纯度 | |
| C. | 酒精灯不慎着火,应立即吹熄 | |
| D. | 眼睛里溅进盐酸,立即用NaOH溶液洗涤眼睛 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com