
分析 在水溶液或熔融状态下能够导电的化合物为电解质,在水溶液和熔融状态下都不能达到的化合物为非电解质,据此解答.
解答 解:A、硫酸钡是盐,熔融状态下能导电,属于电解质;
B、浓硫酸是混合物,既不是电解质也不是非电解质;
C、酒精溶液不能导电,属于混合物,既不是电解质也不是非电解质;
D、氢氧化钠是碱,属于电解质;
E、铜是金属单质,既不是电解质也不是非电解质;
F、蔗糖不能导电,属于非电解质;
G、氨气不能导电,属于非电解质;
H、硝酸钠溶液,是混合物,既不是电解质也不是非电解质,
故答案为:(1)AD; (2)FG.
点评 本题考查了电解质与非电解质的概念,题目难度不大,注意掌握电解质与非电解质的概念及判断方法,明确无论电解质还是非电解质,都一定为化合物.


科目:高中化学 来源: 题型:选择题

| A. | A中一定有Fe2+ | B. | B为AgI沉淀 | ||
| C. | A中可能有Fe3+ | D. | A一定为FeBr2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图所示).
实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图所示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ;此固体所含化学键类型为离子键、共价键;此固体与AB2反应的化学方程式是:2Na2O2+2CO2=2Na2CO3+O2.
;此固体所含化学键类型为离子键、共价键;此固体与AB2反应的化学方程式是:2Na2O2+2CO2=2Na2CO3+O2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
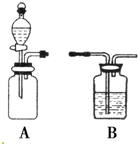 如图是中学化学中常见的实验装置.
如图是中学化学中常见的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
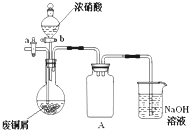 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com