
| A. | 向该容器中增加CO的量可加大反应速率 | |
| B. | 增大H2的用量,有可能使CO转化率达到100% | |
| C. | 使用合适的催化剂、升高温度均可加大反应速率 | |
| D. | 在一定条件下,当CO的浓度不再改变时,反应达到最大限度 |
分析 A.向该容器中增加CO的量可加大正逆反应速率;
B.可逆反应不能完全转化;
C.催化剂、升高温度能加快反应速率;
D.当CO的浓度不再改变时,说明正逆反应速率相等,达平衡状态.
解答 解:A.向该容器中增加CO的量,反应物转化为生成物,所以可加大正逆反应速率,故A正确;
B.可逆反应不能完全转化,所以增大H2浓度不能使CO转化率达到100%,故B错误;
C.选择合适的催化剂、升高温度都能加快反应速率,故C正确;
D.平当CO的浓度不再改变时,说明正逆反应速率相等,达平衡状态,也就是反应达到最大限度,故D正确;
故选B.
点评 本题考查化学平衡及化学反应速率,注意反应为可逆反应、放热反应来分析解答,题目难度不大.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 序号 | 实验方案 | 实验现象 |
| ① | 将少量氯水滴入盛有少量NaBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 加入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色 |
| ② | 将少量溴水滴入盛有少量KI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 加入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
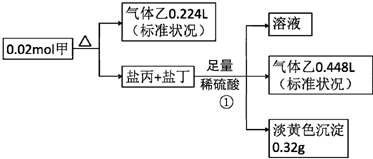
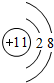 ,甲的化学式Na2S2O4
,甲的化学式Na2S2O4查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的氯化铜溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿的空气中 | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应证明O2能氧化PtF6 | |
| B. | 22.4LO2参加反应时,转移1mol电子 | |
| C. | O2PtF6中既有离子键又有共价键 | |
| D. | 68.2g O2PtF6中含有1.204×1024个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 操作 | 现象 | 结论或目的 |
| (1)取少量溶液于试管中,向溶液中加入足量NaCl溶液 | - | 除尽Ag+ |
| (2)取少量上述溶液于试管中,加入KSCN溶液,振荡 | 溶液变血红色 | 存在Fe3+ |
| (3)取(1)中少量上述溶液于试管中,加入酸性KMnO4溶液,振荡 | 血红色消失 | 存在Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 除杂质的方法 |
| A | 二氧化碳 | 一氧化碳 | 点燃 |
| B | 铁粉 | 铜粉 | 过量稀硫酸溶液、过滤 |
| C | FeCl2溶液 | CuCl2 | 过量铁粉、过滤 |
| D | 一氧化碳 | 二氧化碳 | 通过足量灼热的氧化铜 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com