
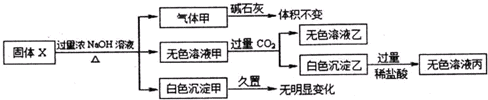
| A、气体甲一定是纯挣物 |
| B、白色沉淀甲可能是混合物 |
| C、固体X中一定存在AlCl3、(NH4)2SO4,MgCl2 |
| D、将过量的无色溶液乙和少量无色溶液丙混合既有无色气体生成,也有白色沉淀生成 |


科目:高中化学 来源: 题型:
| A、500mL 2mol?L-1 葡萄糖溶液中所含分子数为NA |
| B、0.1mol?L-1Na2CO3溶液中的阴离子总数大于0.1NA |
| C、电解精炼铜时,若阳极质量减少64g,则外电路导线上不一定通过2 NA个电子 |
| D、标准状况下,22.4L NO和11.2L O2混合后气体的分子总数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.05mol/L |
| B、0.001mol/L |
| C、0.002mol/L |
| D、0.005mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验编号 | T(℃) | N(CO)/nH2 | P(Mpa) |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钠溶液和稀硫酸 |
| B、氯化铝溶液和氢氧化钠溶液 |
| C、四羟基合铝酸钠溶液和稀盐酸 |
| D、氯化钡溶液和碳酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
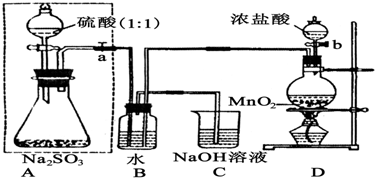
查看答案和解析>>
科目:高中化学 来源: 题型:
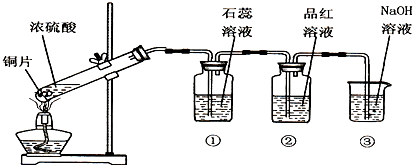
查看答案和解析>>
科目:高中化学 来源: 题型:
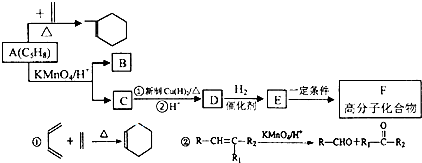
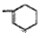 时,A发生的反应类型为
时,A发生的反应类型为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com