
| A. | 浓硫酸稀释后立即转移到容量瓶中 | |
| B. | 将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 | |
| C. | 将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外 | |
| D. | 用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度线相切 |
分析 分析操作对溶质的物质的量n和溶液体积V的影响,依据C=$\frac{n}{V}$进行误差分析,凡是使n偏答,或者使V偏小的操作都会使溶液浓度偏高,反之,溶液浓度偏低,据此解答.
解答 解:A.浓硫酸稀释后立即转移到容量瓶中,浓硫酸稀释产生大量的热,为冷却定容,定容后溶液冷却,液面下降,溶液体积偏小,溶液浓度偏高,故A选;
B.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故B不选;
C.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故C不选;
D.胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度线相切,导致溶液体积偏大,溶液浓度偏低,故D不选;
故选:A.
点评 本题考查了一定物质的量浓度溶液的配制误差分析,明确配制原理依据C=$\frac{n}{V}$进行误差分析即可解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电子式表示HCl的形成过程: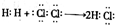 | |
| B. | Mg2+的结构示意图: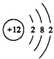 | |
| C. | HClO的结构式:H-Cl-O | |
| D. | 质量数为133,中子数为78的铯原子:${\;}_{55}^{133}$Cs |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2是淡黄色固体,Na2O 是白色固体,二者都能与水反应生成 NaOH | |
| B. | Na和O2在加热时反应生成 Na2O2,在常温下反应生成 Na2O | |
| C. | Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成 O2 | |
| D. | 2 g H2充分燃烧后产物被Na2O2完全吸收,Na2O2固体增重2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
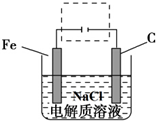 、Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2(胶体)+H2↑
、Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2(胶体)+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (用元素符号表示)
(用元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑥ | B. | ②③⑤⑥ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液与过量NaOH溶液反应可制得Ca(OH)2 | |
| B. | 用CO2可以鉴别NaAlO2溶液和CH3COONa溶液 | |
| C. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| D. | 用BaCl2可以溶液鉴别AgNO3溶液和K2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com