
 H、C、N、O是几种重要的非金属元素.回答以下问题:
H、C、N、O是几种重要的非金属元素.回答以下问题: .
.分析 (1)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素;
(2)一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力;
(3)与CO2是等电子体,可检验溶液中Fe3+的阴离子为SCN-,根据与CO2是等电子体,等电子体具有相似的结构确定SCN-中各原子的连接顺序以及成键方式书写离子电子式;
(4)①反应中有4mol N-H键断裂,生成1.5molN2,根据结构式N≡N判断;
②根据硫酸铵晶体中存在的化学键判断;
(5)嵌入某微粒分别与4个N原子形成4个氢键.
解答 解:(1)C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N>O>C,故答案为:N>O>C;
(2)H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H-O-H键角比H2O中H-O-H键角大.
故答案为:H2O中O原子有两对孤对电子,H3O+中O原子只有1对孤对电子,对O-H 键排斥力减小;
(3)与CO2是等电子体,可检验溶液中Fe3+的阴离子为SCN-,因氧与硫的最外层电子数相同,根据题目信息,确定SCN-中各原子的连接顺序为S-C-N,S与C形成一对共用电子对,C与N形成三对共用电子对,SCN-得到的一个电子给了S,故SCN-的电子式 ,故答案为:
,故答案为: ;
;
(4)①N2O4+2N2H4═3N2+4H2O,若该反应中有4mol N-H键断裂,即有1mol N2H4参加反应,生成1.5mol N2,形成π键的物质的量为2×1.5mol=3mol,
故答案为:3;
②3N2H6SO4和(NH4)2SO4都是离子晶体,N2H6 2+和SO42-之间存在离子键,N2H62+中N和H之间形成6个共价键(其中2个配位键),N和N之间形成共价键,SO42-中S和O之间形成共价键,不含范德华力,
故选:d;
(5)由氢键的形成条件及成键元素(N、O、F、H)可知,本题中嵌入某微粒分别与4个N原子形成4个氢键,由成键元素及数目可知为NH4+,故答案为:c.
点评 本题考查了第一电离能、化学键、等电子体等知识点,题目难度中等,注意分子空间构型的判断及原子杂化方式的判断是高考的热点.


科目:高中化学 来源: 题型:选择题
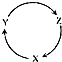 下列各组物质中,满足下如图物质一步转化关系的选项是( )
下列各组物质中,满足下如图物质一步转化关系的选项是( )| X | Y | Z | |
| A | Na | NaOH | NaHCO3 |
| B | Cu | CuSO4 | Cu(OH)2 |
| C | C | CO | CO2 |
| D | Si | SiO2 | H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
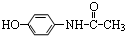 ,则有关它的性质错误的是( )
,则有关它的性质错误的是( )| A. | 与氢氧化钠溶液共热消耗2molNaOH | B. | 能与浓溴水发生取代反应 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 遇三氯化铁溶液呈现紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com