
| 3.2g |
| 64g/mol |
| 25 |
| 3 |
| 25 |
| 3 |
| 25 |
| 3 |


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
| A、快速逃离火灾现场时,应用湿毛巾捂口鼻弯腰呼吸,因为许多易燃有机高分子材料燃烧时会释放出大量有毒气体,而且热气体的密度比空气轻 |
| B、吃米饭或馒头时,多加咀嚼会感到甜味,是因为淀粉发生水解反应生成了麦芽糖 |
| C、油脂是人类的主要食物之一,“地沟油”对人体的危害极大 |
| D、肥皂的去污原理与合成洗涤剂的去污原理不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
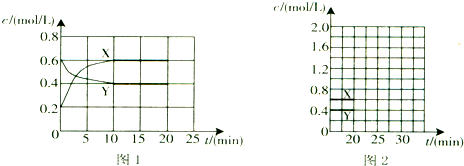
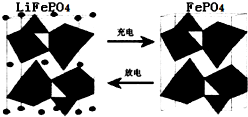
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
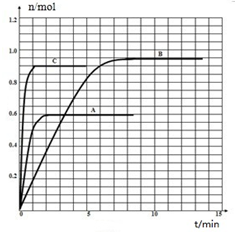
查看答案和解析>>
科目:高中化学 来源: 题型:
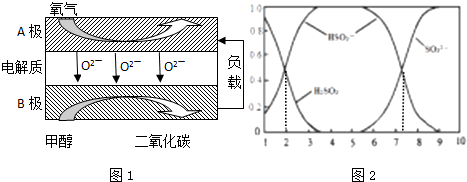
查看答案和解析>>
科目:高中化学 来源: 题型:
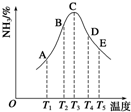 在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2(g)+3H2(g)?2NH3(g),并分别在t秒时测定其中NH3的体积分数,如图:
在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2(g)+3H2(g)?2NH3(g),并分别在t秒时测定其中NH3的体积分数,如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2和H2具有的总能量一定比NH3具有的总能量低 |
| B、a、b、c三者的关系为:a+3b<2c |
| C、向密闭容器中通入1mol N2和3mol H2,反应放出的热量必为(6c-a-3b)kJ |
| D、形成1mol N-H会放出c kJ热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com