
| A. | vA=0.15mol•L-1•min-1 | B. | vB=0.6mol•L-1•min-1 | ||
| C. | vC=0.4mol•L-1•min-1 | D. | vD=0.01mol•L-1•s-1 |
科目:高中化学 来源: 题型:解答题

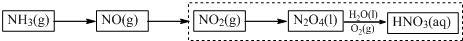

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用带橡皮塞的试剂瓶保存烧碱溶液 | |
| B. | 过氧化钠密封保存在细口玻璃瓶中 | |
| C. | 金属钠保存在液体石蜡或煤油中 | |
| D. | 氯水保存在带磨口玻璃塞的棕色试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解熔融态的Al2O3、12C转化为14C都属于化学变化 | |
| B. | Cu2(OH)2CO3、冰水混合物、四氧化三铁都不是混合物 | |
| C. | 葡萄糖溶液和淀粉溶液两种分散系的本质区别是能否产生丁达尔效应 | |
| D. | SiO2、NO2、CO2都属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀 | |
| B. | 除去FeCl2中少量的FeBr2,加入适量氯水,再加四氯化碳萃取分液 | |
| C. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入KNO3固体,铜粉仍不溶解 | |
| D. | 向AlCl3溶液中滴加1mol/L NaOH溶液10ml,产生白色沉淀;再加入1mol/L NaHSO4溶液10ml,沉淀恰好消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与Al反应可放出H2的溶液中:Fe2+、Cl-、NO3-、Na+ | |
| B. | 甲基橙呈红色的溶液中:Na+、AlO2-、NO3-、HCO3- | |
| C. | 由水电离出的c(H+)=10-11mol/L的溶液中:Fe3+、Na+、NO3-、CH3COO- | |
| D. | 含大量OH一的溶液中:CO32-、Cl-、F-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室需要0.80mol/L NaOH溶液475mL和0.40mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.80mol/L NaOH溶液475mL和0.40mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定没有甲烷 | B. | 一定没有乙烷 | ||
| C. | 可能是甲烷和丙烷的混合物 | D. | 可能是乙烷和丙烷的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com