
【题目】非金属硼的合金及其化合物有着广泛的用途。
(1)硼钢合金的硬度是普通钢材的 4 倍,其主要成分是铁。 画出基态铁原子的价电子排布图_____。
(2)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键, 则氨硼烷分子结构式为_____。写出一种与氨硼烷互为等电子体的分子_____(填化学式)。
(3)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如右图所示。
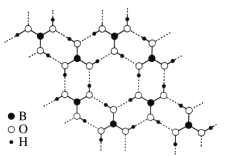
①1 mol H3BO3晶体中含有______mol 氢键。
②请从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大的原因:__________。
(4)硼氢化钠是一种常用的还原剂。其晶胞结构如右图所示:

①该晶体中Na+的配位数为_____。
②H3BO3 分子中的 O—B—O 的键角_____(填“大于”、“等于”或“小于”) BH4-中的 H—B—H 的键角,判断依据是_____。
③已知硼氢化钠晶体的密度为 ρ g/cm3, NA代表阿伏伽德罗常数的值,则 a=_____(用含 ρ、 NA的代数式表示);④若硼氢化钠晶胞上下底心处的 Na+被 Li+取代,得到的晶体的化学式为_____。
【答案】 ![]()
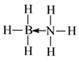 C2H6 3 硼酸分子间通过氢键结合,加热时氢键被破坏,有利于硼酸溶解 8 大于 H3BO3分子中的B采取sp2杂化,而BH4-中的B采取sp3杂化,sp2杂化形成的键角大于sp3杂化
C2H6 3 硼酸分子间通过氢键结合,加热时氢键被破坏,有利于硼酸溶解 8 大于 H3BO3分子中的B采取sp2杂化,而BH4-中的B采取sp3杂化,sp2杂化形成的键角大于sp3杂化 ![]() Na3Li(BH4)4
Na3Li(BH4)4
【解析】(1)基态铁原子的价电子排布图为![]() ;
;
(2)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键,N原子有孤对电子,B原子有空轨道,故形成配位键,所以其结构式为: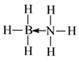 ;氨硼烷是6原子14价电子分子,与其互为等电子体的分子是:C2H6;
;氨硼烷是6原子14价电子分子,与其互为等电子体的分子是:C2H6;
(3)①根据图示,1个硼酸分子参与形成6个氢键,一个氢键由两个分子形成,所以1个硼酸分子形成3个氢键,故1 mol H3BO3晶体中含有3mol 氢键;
②由于硼酸(H3BO3)分子间形成氢键,故其溶于冷水时,与水形成的氢键数少,因此在冷水中的溶解度小,而加热时,硼酸分子间的氢键被破坏,有利于硼酸分子与水形成氢键,溶解度增大;
(4)①根据其晶胞,该晶体中 Na+周围最近的BH4-为8个,故Na+的配位数为8;
②H3BO3分子中的B采取sp2杂化,构型为平面三角形,键角为120°,而BH4-中的B采取sp3杂化,构型为正四面体,键角为109°28,故H3BO3 分子中的 O—B—O 的键角大于BH4-中的 H—B—H 的键角;
③该晶胞中有4个Na+,4个BH4-,该晶胞的体积=2a3×10-21 cm3=![]() ,故a=
,故a=![]() m;
m;
④若硼氢化钠晶胞上下底心处的 Na+被 Li+取代,则晶胞中有1个Li+,3个Na+,4个BH4-,得到的晶体的化学式为Na3Li(BH4)4。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】现有A、B、C,D、E、G六种前四周期主族元素,已知A、B、C、D、E五种元素在元素周期表中的位置如图所示。

(1)若非金属元素B的核电荷数为x,则A、B、C、D、E五种元素的核电荷数之和为_________。
(2)若A、B、C、D四种元素的核内质子数之和为56,lmolG的单质与足量盐酸反应,能产生22. 4LH2(在标准状况下);G的阳离子与D的阴离子核外电子层结构相同。
①写出下列元素名称:A_________,B________;
②D的简单离子结构示意图为_________;
③氢化物的沸点:D_________B,简单氢化物水溶液的酸性:B_________C(填“>”“<”或“=”)。
④甲为G、C两元素组成的化合物,用电子式表示甲的形成过程_________。
(3)下列说法正确的是_________(填序号)
A.氢键是极弱的化学键,任何物质中都存在化学键
B.共价化合物中成键原子均满足稀有气体的稳定结构
C.两种非金属元素形成的化合物可能含有离子键
D.化学键断裂,一定发生化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有以下各组微粒或物质:A.正丁烷和异丁烷 B.金刚石、石墨和C60 C.冰和干冰 D.35Cl和37Cl E.NO和NO2;其中,互为同分异构体的有__________(填编号,以下同);互为同素异形体的有__________。
(2)现有:①干冰 ②金刚石 ③NH4Cl ④Na2S四种物质,按下列要求回答(填序号):熔化时不需要破坏化学键的是____________;既存在离子键又存在共价键的是____________。
(3)向一个容积为2 L的密闭容器中充入7 mol SO2和4 mol O2,在一定温度和压强下,发生如下反应:2SO2(g)+O2(g) 2SO3(g),经4 s后达到平衡状态,测得SO2的物质的量是3 mol,则达到平衡状态时O2的转化率为__________;平衡时SO3的物质的量浓度_______。
(4) NaBH4(s)与H2O(l)反应生成NaBO2(s)和氢气,在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1mol化合物 ![]() 分别与足量的浓溴水、足量的NaOH溶液反应,消耗Br2和NaOH的物质的量相等
分别与足量的浓溴水、足量的NaOH溶液反应,消耗Br2和NaOH的物质的量相等
B.等质量的乙醇、乙烯、甲烷分别充分燃烧,所耗用氧气的量依次减少
C.聚乳酸( ![]() )是由单体之间通过加聚反应合成的
)是由单体之间通过加聚反应合成的
D.实验证实 ![]() 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键
可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除氮氧化物和硫氧化物有多种方法。
(1)用活性炭还原法: 某研究小组向某密闭容器中加入足量的活性炭和 NO,发生反应:C(s)+2NO(g) ![]() N2(g)+CO2(g) H=Q kJ·mol-1 在 T1℃下,反应进行到不同时间测得各物质的浓度部分数据如下:
N2(g)+CO2(g) H=Q kJ·mol-1 在 T1℃下,反应进行到不同时间测得各物质的浓度部分数据如下:

①0~10 min 内, N2 的平均反应速率 υ(N2)=________ , T1℃时,该反应的平衡常数 K=_____。
②30 min 后,若只改变一个条件,反应重新达到平衡时各物质的浓度如上表所示,则改变的条件可能是____________ (填字母)
a. 加入一定量的活性炭 b. 改变反应体系的温度
c. 缩小容器的体积 d. 通入一定量的 NO
③若 30 min 后升高温度至 T2℃,重新达到平衡时,容器中 NO、 N2、 CO2 的浓度之比为 7∶3∶3,则该反应的H______0(填“>” 、 “ =” 、或“<” )
(2)NH3 催化还原法: 原理如图所示
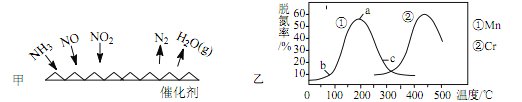
①若烟气中 c(NO2): c(NO)=1∶1,发生如图甲所示的脱氮反应时,反应过程中转移 1.5mol 电子时放出的热量为 113.8 kJ,则发生该脱氮反应的热化学方程式为_____ 。
②图乙是在一定时间内,使用不同催化剂 Mn 和 Cr 在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应温度分别为_____ ;使用 Mn 作催化剂时,脱氮率 b~a 段呈现如图变化的可能原因是_____。
(3)已知常温下 Ka1(H2SO3)=1.810-2, Ka2(H2SO3)=6.010-9。 汽车尾气中的 SO2 用石灰水来吸收,生成的 CaSO3 浊液 pH=9.0,忽略 SO32-的第二步水解,则Ksp(CaSO3)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 H 是一种抗病毒药物,在实验室中利用芳香烃 A 制备 H 的流程如下图所示(部分反应条件已略去):
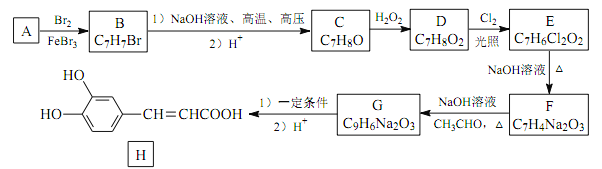
己知: ①有机物 B 苯环上只有两种不同环境的氢原子;
②两个羟基连在同一碳上不稳定,易脱水形成羰基或醛基;
③ RCHO + CH3CHO NaOH![]() RCH CHCHO + H2O;
RCH CHCHO + H2O;
④
(1)有机物 B 的名称为_____。
(2)由 D 生成 E 的反应类型为___________ , E 中官能团的名称为_____。
(3)由 G 生成 H 所需的“一定条件” 为_____。
(4)写出 B 与 NaOH 溶液在高温、 高压下反应的化学方程式:_____。
(5)F 酸化后可得 R, X 是 R 的同分异构体, X 能发生银镜反应,且其核磁共振氢谱显示有 3 种不同化学环境的氢,峰面积比为 1∶1∶1,写出 2 种符合条件的 X 的结构简式:_____。
(6)设计由 ![]() 和丙醛合成
和丙醛合成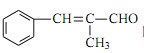 的流程图:_______________(其他试剂任选)。
的流程图:_______________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可用于合成除草剂和杀虫剂。一定条件下,恒容密闭容器中,发生反应H2S(g)+CO2(g) ![]() COS(g)+H2O(g),能充分说明该反应已经达到化学平衡状态的是
COS(g)+H2O(g),能充分说明该反应已经达到化学平衡状态的是
A. 正、逆反应速率都等于零
B. H2S、CO2、COS、H2O的浓度相等
C. H2S、 CO2、COS、H2O的浓度不再变化
D. H2S、CO2、COS、H2O在密闭容器中共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列六个说法中,正确的有
①已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为ΔH=-241.8 kJ·mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g) ![]() Z(g)+W(g) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
Z(g)+W(g) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
④已知:
共价键 | C—C | C=C | C—H | H—H |
键能/(kJ·mol-1) | 348 | 610 | 413 | 436 |
根据上表数据可以计算出C6H6(g)+3H2(g)→C6H12(g)的焓变
⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2固体时,放出的热量相等
⑥25 ℃、101 kPa时,1 mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析祛处理废液(HCl和FeCl2混合溶液)的原理如图所示,其中X、Y均为离子交换膜。在直流电场的作用下,中间室得到盐酸,阴极区可回收铁。下列说法正确的是
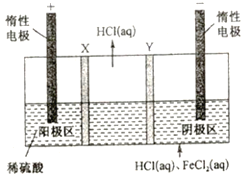
A. X、Y依次是阴离子透过膜和阳离子透过膜
B. 通电后,阴极区溶液的pH不断减小
C. 阳极反应式为2H2O-4e-==4H++O2↑
D. 中间室得到1L2mol/L盐酸时,电路中通过1mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com