
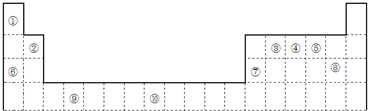
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
分析 由元素在周期表中位置,可知①为H、②为Be、③为C、④为N、⑤为O、⑥为Na、⑦为Al、⑧为Cl、⑨为Ti、⑩为Fe.
(1)元素⑩为Fe,核外电子排布为1s22s22p63s23p63d64s2;
(2)分子间存在氢键,H2O分子发生缔合;
(3)元素②的氢氧化物为Be(OH)2,与氢氧化铝性质相似,Be(OH)2与NaOH溶液反应生成NaBeO2与水;
(4)由元素的电离能可以看出,Q的电离能很大,可能为零族元素,R和U的第一电离能较小,第二电离能剧增,故表现+1价,最外层电子数为1,二者位于同一族,S的第一、第二电离能较小,第三电离能剧增,故表现+2价,最外层电子数为2,T的第一、第二、第三电离能较小,第四电离能剧增,表现+3价,最外层电子数为3.
①R和U的第一至第四电离能变化规律相似,即R和U最可能在同一主族;
②T元素第四电离能剧增,最外层电子数为3,外围电子排布为ns2np1,若T为第二周期元素,则T为B元素,Z是第三周期元素中原子半径最小的主族元素,则Z为Cl,二者形成化合物为BCl3,B原子形成3个B-Cl键,不含孤电子对,为平面正三角形结构.
解答 解:由元素在周期表中位置,可知①为H、②为Be、③为C、④为N、⑤为O、⑥为Na、⑦为Al、⑧为Cl、⑨为Ti、⑩为Fe.
(1)元素⑩为Fe,核外电子排布为1s22s22p63s23p63d64s2,次外层电子排布为3s23p63d6,次外层电子数为14,
故答案为:14;
(2)分子间存在氢键,H2O分子发生缔合,相对分子质量测定结果比理论值高,
故答案为:分子间存在氢键,H2O分子发生缔合;
(3)元素②的氢氧化物为Be(OH)2,与氢氧化铝性质相似,Be(OH)2与NaOH溶液反应生成NaBeO2与水,反应离子方程式为:2OH-+Be(OH)2=BeO22-+2H2O,
故答案为:2OH-+Be(OH)2=BeO22-+2H2O;
(4)由元素的电离能可以看出,Q的电离能很大,可能为零族元素,R和U的第一电离能较小,第二电离能剧增,故表现+1价,最外层电子数为1,二者位于同一族,S的第一、第二电离能较小,第三电离能剧增,故表现+2价,最外层电子数为2,T的第一、第二、第三电离能较小,第四电离能剧增,表现+3价,最外层电子数为3.
①由上述分析可知,R和U的第一电离能较小,第二电离能剧增,故表现+1价,最外层电子数为1,二者位于同一族,
故答案为:R和U;
②T元素第四电离能剧增,最外层电子数为3,外围电子排布为ns2np1,处于周期表中p区,若T为第二周期元素,则T为B元素,Z是第三周期元素中原子半径最小的主族元素,则Z为Cl,二者形成化合物为BCl3,B原子形成3个B-Cl键,不含孤电子对,为平面正三角形结构,键角为:120°,
故答案为:p;120°.
点评 本题是对物质结构与性质的考查,涉及元素周期表、核外电子排布、元素周期律、氢键、电离能、化学键等,注意氢键对物质性质的影响,理解电离能与电子数关系,难度中等.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 小苏打与醋酸反应:HCO3-+H+═CO2↑+H2O | |
| C. | 三氯化铁溶液中加入铁粉:Fe3++Fe═2Fe2+ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠 | B. | 氯化钾 | C. | 氯化铜 | D. | 氯化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应热就是反应中放出的能 | |
| B. | 在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 | |
| C. | 由C(s,石墨)=C(s,金刚石),△H=1.9 kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能有甲烷 | B. | 一定有乙烯 | C. | 可能有丙炔 | D. | 一定无C4H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com