
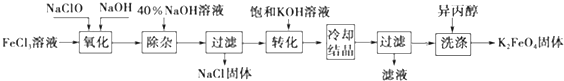
分析 方法一:湿法为次氯酸盐氧化法,工艺流程:氯化铁溶液中加入次氯酸钠和氢氧化钠,反应为:2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O;将Na2FeO4粗产品在40%KOH溶液中溶解,过滤除去杂质NaCl,加入饱和KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4,反应方程式为Na2FeO4+2KOH=K2FeO4+2NaOH,冷却结晶,过滤,高铁酸钾易溶于水,难溶于异丙醇,用异丙醇代替水洗涤产品可以减少高铁酸钾的损耗,同时洗去高铁酸钾晶体表面的KOH和其他杂质,得到纯产品高铁酸钾.
(1)反应中NaClO是氧化剂,还原产物是NaCl,根据元素守恒,可知反应式中需要补充NaCl和H2O.根据化合价升降法配平方程式;
(2)加入饱和KOH溶液可以增大K+的浓度,使平衡向右移动;高铁酸钾在水中的溶解度远远大于在异丙醇中的溶解度;
方法二:干法
(3)根据含元素化合价升高的物质为还原剂,含元素化合价降低的物质为氧化剂,并利用化学反应方程式中的化学计量数来分析氧化剂与还原剂的物质的量之比.
解答 解:湿法为次氯酸盐氧化法,工艺流程:氯化铁溶液中加入次氯酸钠和氢氧化钠,反应为:2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O;将Na2FeO4粗产品在40%KOH溶液中溶解,过滤除去杂质NaCl,加入饱和KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4,反应方程式为Na2FeO4+2KOH=K2FeO4+2NaOH,冷却结晶,过滤,高铁酸钾易溶于水,难溶于异丙醇,用异丙醇代替水洗涤产品可以减少高铁酸钾的损耗,同时洗去高铁酸钾晶体表面的KOH和其他杂质,得到纯产品高铁酸钾.
方法一:湿法
(1)反应中FeCl3→Na2FeO4,铁元素化合价由+3价升高为+6价,化合价总升高3价,NaClO→NaCl,氯元素化合价由+1降低为-1价,化合价总共降低2价,化合价升降最小公倍数为6,故FeCl3系数为2,NaClO系数为3,由铁元素守恒可知 Na2FeO4系数为2,由氯元素守恒可知NaCl系数为2×3+3=9,根据钠元素守恒可知NaOH系数为9+2×2=13,由氢元素守恒可知H2O系数为5,配平方程式为2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O;
反应中NaClO→NaCl,氯元素化合价由+1降低为-1价,NaClO是氧化剂,还原产物是NaCl.
故答案为:2、10、3、2、9NaCl、5H2O;NaClO;
(2)Na2FeO4+2KOH?K2FeO4+2NaOH,加入饱和KOH溶液可以增大K+的浓度,使平衡向右移动,析出晶体,高铁酸钾易溶于水,难溶于异丙醇,用异丙醇代替水洗涤产品可以减少高铁酸钾的损耗,同时洗去高铁酸钾晶体表面的KOH和其他杂质,得到纯产品高铁酸钾,
故答案为:减小高铁酸钾的溶解,促进高铁酸钾晶体析出;减少高铁酸钾的损耗;
方法二:干法.
(3)Fe2O3+3KNO3+4KOH═2K2FeO4+3KNO2+2H2O,氮元素的化合价由+5价变为+3价,铁元素的化合价由+3价变为+6价,则KNO3为氧化剂,Fe2O3为还原剂,氧化剂与还原剂的物质的量之比为3:1,
故答案为:3:1.
点评 本题考查物质制备,为高频考点,涉及氧化还原反应、除杂、氧化还原反应配平等知识点,明确氧化还原反应基本概念、实质及物质分离和提纯方法与物质性质关系是解本题关键,熟悉流程图中各个步骤可能发生的反应、基本操作、设计目的,题目难度中等.


科目:高中化学 来源: 题型:选择题
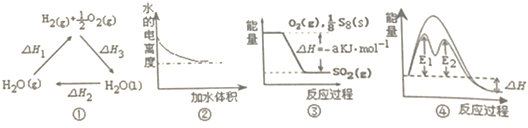
| A. | 图①中△H1=△H2+△H3 | |
| B. | 图②表示0.1mol•L-1氨水加水稀释过程中水的电离度变化曲线 | |
| C. | 图③可知S8燃烧的热化学方程式为S8(s)+8O2(g)=8SO2(g)△H=-8akJ•mol-1 | |
| D. | 图④在催化剂条件下,反应的活化能等于E1+E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度能加快反应速率 | B. | 使用恰当的催化剂能加快反应速率 | ||
| C. | 将氨气液化排出能加快反应速率 | D. | N2与H2不能完全转化为NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,实验中,可以观察到反应②的现象是:气体由无色变红棕色.
,实验中,可以观察到反应②的现象是:气体由无色变红棕色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ Mg2+ I- SO32- | B. | Mg2+ Na+ CO32- I- | ||
| C. | Al3+Na+ SO32- I- | D. | Na+ CO32- Br-I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com