
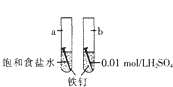
| A. | a是吸氧腐蚀,b是化学腐蚀 | |
| B. | a的负极反应时Fe-3e-═Fe3+ | |
| C. | a、b两处铁钉用导线联通有电流通过 | |
| D. | b前期发生析氢腐蚀,后期发生吸氧腐蚀 |
分析 A、a中电解质溶液显中性,为铁钉的吸氧腐蚀,b中电解质溶液为稀硫酸,显酸性为析氢腐蚀;
B、Fe失电子为原电池的负极;
C、原电池中要形成闭合回路才会出现电流;
D、根据电解质的环境确定金属发生腐蚀的类型.
解答 解:A、a中电解质溶液显中性,为铁钉的吸氧腐蚀,b中电解质溶液为稀硫酸,显酸性为析氢腐蚀;
B、a的负极反应时Fe-2e-═Fe2+,故B错误;
C、a、b两处铁钉用导线联通后,因为是断路所以没有电流产生,故C错误;
D、b中电解质溶液为稀硫酸,前期发生析氢腐蚀,随着氢离子的消耗,当溶液显示中性时,铁钉会发生吸氧腐蚀,故D正确.
故选D.
点评 本题考查了金属的腐蚀,试管内电解质溶液的酸碱性来确定铁发生腐蚀类型,再结合发生析氢腐蚀和吸氧腐蚀的原理来分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH3+Cl2$\stackrel{高温}{→}$CH2=CHCH2Cl+HCl | |
| B. | 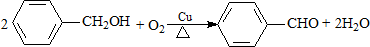 | |
| C. | 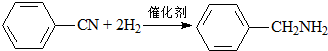 | |
| D. | 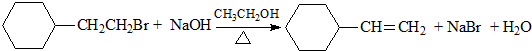 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
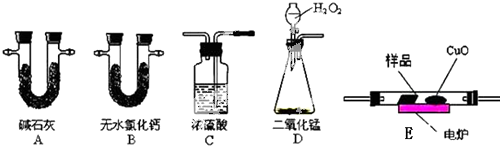
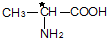 取4.4g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8g,B管增重3.6g.请回答:
取4.4g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8g,B管增重3.6g.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Q1=Q | B. | 2Q1<Q | C. | 2Q1>Q | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若向该溶液中加人过量的稀硫酸和KSCN溶液,溶液显血红色 | |
| B. | 若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色 | |
| C. | 该溶液中所含的离子是Fe2+、Na+、SO42-、NO3- | |
| D. | 若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为566.0 kJ•mol-1 | |
| B. | 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 | |
| C. | 完全燃烧20g甲醇,生成二氧化碳和水蒸气时放出的热量为908.3 kJ | |
| D. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1453.28 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将28.8g铜投入100ml浓硝酸中,最后铜剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:
将28.8g铜投入100ml浓硝酸中,最后铜剩余,其NO3-离子物质的量变化如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成40.0 L N2(标准状况) | |
| B. | 有0.250 mol KN03被氧化 | |
| C. | 转移电子的物质的量为1.25 mol | |
| D. | 被氧化的N原子的物质的量为2.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com