
(13分)[化学——物质结构与性质]由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态 Cu+ 的核外电子排布式为 。在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因: 。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于 晶体。
(3)化合物A (H3BNH3) 是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3通过3CH4 + 2 (HB=NH)3 + 6H2O →3CO2 + 6H3BNH3 制得。
①与上述化学方程式有关的叙述不正确的是 。(填标号)
| A.反应前后碳原子的轨道杂化类型不变 |
| B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
| C.第一电离能:N>O>C>B |
| D.化合物A中存在配位键 |

(1) [Ar]3d10 ;结构上Cu2+为3d9,而Cu+为3d10全充满更稳定 (2) 原子晶体
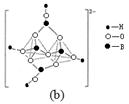
(3) ① A ②12 (4) [BO2]nn-(或BO2-);sp2、sp3
解析试题分析:(1)Cu是29号元素。基态 Cu+ 的核外有28个电子。核外电子排布式为[Ar]3d10 ;在高温下CuO 能分解生成Cu2O,是因为CuO在变为Cu2O时,其中的Cu的结构由Cu2+的3d9变为3d10的全充满Cu+。更稳定的结构。(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于原子晶体。(3)①A. 在反应前后CH4中的碳原子的轨道杂化类型是sp3杂化,在反应后CO2中的碳原子的轨道杂化类型是sp杂化。轨道杂化类型改变。错误。B. CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形。正确。C. 一般情况下,同一周期的元素,元素的非金属性越强,原子半径越小,第一电离能越大。但是由于N原子的核外电子是处于半充满的稳定状态,所以其第一电离能比O盐酸的还大。因此第一电离能大小关系是:N>O>C>B。正确。D. 在化合物A中的N原子上存在配位键。正确。②由H3BNH3的分子结构可知在1个(HB=NH)3分子中有12个σ键.(4)由图(a)可知多硼酸根离子符号为BO2-或[BO2]nn-。由图(b)硼砂晶体可知:其中硼原子采取的杂化类型sp2、sp3 两种类型。
考点:考查原子或离子的核外电子排布、晶体结构、原子的杂化方式、分子的空间关系等知识。


科目:高中化学 来源: 题型:填空题
X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X原子的L层电子数是K层电子数的2倍 |
| Y | Y原子的最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的原子核 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
1808年,英国化学家戴维用钾还原氧化镁,最早制得少量的镁。镁是航空工业的重要材料,镁合金用于制造飞机机身、发动机零件等,一架超音速飞机约有5%的镁合金构件,一枚导弹一般消耗100~200公斤镁合金;镁作为一种强还原剂,还用于钛、锆、铍和铀等的生产中;镁是燃烧弹和照明弹不能缺少的组成物;镁粉是节日烟花必需的原料。镁及其合金是一种用途很广泛的金属材料,目前世界上60%的镁是从海水中提取的。从海水(主要含NaCl和MgSO4)中提取金属镁的主要步骤如下:
回答下列问题:
(1)Mg在周期表中的位置______________________,试剂A可以选用_____________________,试剂C可选用_______________________;
(2)步骤①的离子方程式_________________________________________;
(3)用电子式表示氯化镁的形成过程_______________________________;
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为:_____________________________________________________;
(5)戴维制镁的化学方程式为_____________________________________;
(6)配平下列反应的方程式。
① 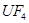 +
+ 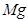 ——
——  +
+ 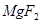
② 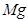 +
+ 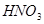 ——
—— 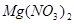 +
+ 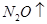 +
+ 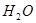
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
人民网2012年11月8日西宁电,青海盐湖海纳化工有限公司15万吨电石项目投产。以电石(CaC2 )为原料可生产许多重要的有机物质,电石可由CaO制得(同时还得到一种可燃性气体物质),有关转化关系如下图所示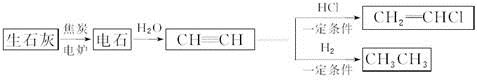
(1)写出制备电石及由电石生成乙炔的化学方程式为__________________、__________________。
(2)基态Ca2+的电子排布式为______________,上面转化关系图中涉及到的元素中,电负性最大的元素是______________,第一电离能最小的元素是________________。
(3)乙炔、乙烷分子中的碳原子杂化类型分别为________________、______________,甲烷的空间构型是________________,该空间构型中,键角__________(填>、<、=)109°28′。
(4)与CH2=CH2相比,CH2=CHCl属于易液化的气体,原因是___________________。
(5)假设下图是电石的晶胞,则一个晶胞中含有________个钙离子,研究表明,亚玲形C的存在,使晶胞沿一个方向拉长,则该晶胞中一个Ca2+周围距离相等且最近的C有________个。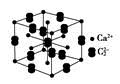
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为______________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为_______________、_______________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_______________;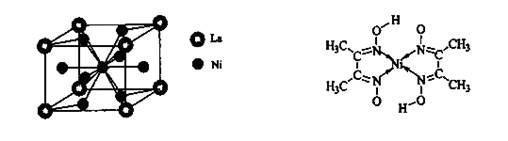
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是 键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
②该结构中,氧氢之间除共价键外还可存在_______________;
③该结构中,碳原子的杂化轨道类型有_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
【物质结构与性质】
芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。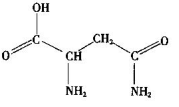
(1)天冬酰胺所含元素中_______(填元素名称)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型有_______种。
(3)H2S和H2Se的参数对比见下表。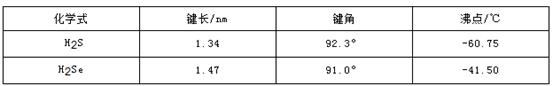
①H2Se的晶体类型为_________,含有的共价键类型为_________。
②H2S的键角大于H2Se的原因可能为____________________。
(4)已知钼(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示
A是____________(填元素符号),B的价电子排布式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
四种元素A、B、C、D,其中A元素原子的原子核内只有一个质子;B的基态原子s能级的总电子数比p能级的总电子数多1;C元素的原子最外层电子数是次外层的3倍; D是形成化合物种类最多的元素。
(1)A、D形成的某种化合物甲是一种重要的化工产品,可用作水果和蔬菜的催熟剂,甲分子中σ键和π键数目之比为________;写出由甲制高聚物的反应方程式 。
(2)A、C形成的某种化合物乙分子中含非极性共价键,乙分子属于________(“极性分子”或“非极性分子”);其电子式________;将乙加入浅绿色酸性溶液中,溶液变为棕黄色,写出该反应的离子方程式 。
(3)写出B的基态原子电子排布图为 。与PH3相比,BA3易液化的主要原因是___________________________________;
(4)笑气(B2C)是一种麻醉剂,有关理论认为B2C与DC2分子具有相似的结构。故B2C的空间构型是________,其为________(填“极性”或“非极性”)分子 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
短周期主族元素A、B、C、D、E、F 的原子序数依次增大,它们的原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1∶1的原子个数比形成的化合物的电子式: _____ 。F的原子结构示意图为: 。
(2)B、D形成的化合物BD2中存在的化学键为 键(填“离子”或“共价”,下同)。A、C、F三种元素形成的化合物CA4F为 _____ 化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为: 。
(4)A、C、D、E的原子半径由大到小的顺序是 (用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性 ____ 于F(填“强”或“弱”),并用化学方程式证明上述结论 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知[Co(NH3)6]3+呈正八面体结构,若其中有两个NH3分子分别被H2O取代, 所形成的[Co(NH3)4(H2O)2]3+的几何异构体种数有(不考虑光学异构)几种( ) 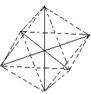
| A.2种 | B.3种 | C.4种 | D.6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com