
| A. | 纯碱属于碱 | B. | 钢属于纯净物 | ||
| C. | 冰醋酸属于混合物 | D. | 水属于氧化物 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
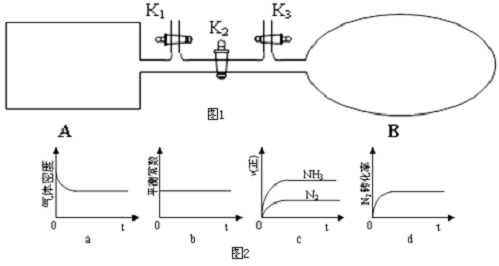
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
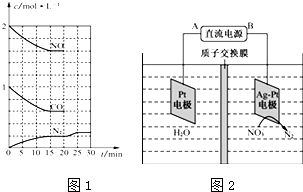
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者均可作为水果催熟剂 | |
| B. | 二者均可使酸性高锰酸钾溶液褪色 | |
| C. | 常温常压下二者均为难溶于水的气体 | |
| D. | 在一定条件下二者均能与氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
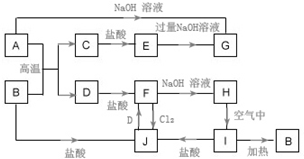 A~J为中学化学的常见物质,它们之间有如图所示的转化关系(部分产物已略去).已知A、D为金属单质,B为红棕色粉末,I为红褐色固体.
A~J为中学化学的常见物质,它们之间有如图所示的转化关系(部分产物已略去).已知A、D为金属单质,B为红棕色粉末,I为红褐色固体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 雷琐苯乙酮所有碳原子不可能共平面 | |
| B. | 雷琐苯乙酮、伞形酮能用酸性KmnO4鉴别 | |
| C. | 1mol雷琐苯乙酮跟足量H2反应,最多消耗3molH2 | |
| D. | 1mol伞形酮与足量NaOH溶液反应,最多消耗3molNaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com