
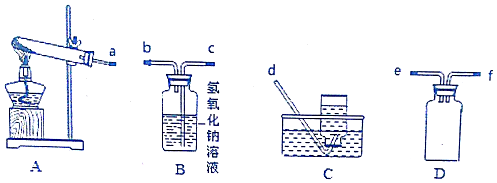
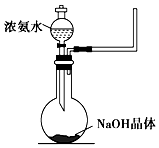
分析 (1)装置A是加热硝酸银的发生装置,生成的气体需要通过溶液,所以在通过溶液前需要防止倒吸,通过装置D为安全瓶,通过装置B吸收生成的二氧化氮气体,通过装置C收集生成的氧气,给固体加热试管口应略向下倾斜,防止生成的水蒸气冷凝倒流炸裂试管;
(2)加热时放出红棕色气体,当反应结束后,试管中残留固体为黑色,可能为单质银或氧化银;
(3)带火星的木条遇到氧气会复燃,分解生成的二氧化氮和氧气若按照4:1全部溶于水反应生成硝酸,硝酸和氢氧化钠溶液反应;
(4)利用0.1mol•L-1AgNO3溶液和同浓度、同体积的0.1mol/LNaCl溶液和NaI溶液反应观察出现现象判断,阴阳离子比相同难溶物可以利用沉淀快慢比较溶度积常数.
解答 解:(1)装置A是加热硝酸银的发生装置,生成的气体需要通过溶液,所以在通过溶液前需要防止倒吸,通过装置D为安全瓶,通过装置B吸收生成的二氧化氮气体,通过装置C收集生成的氧气,按照气流方向连接装置的接口顺序为aefcbd,装置A试管口稍微向下倾斜的原因是防止固体表面吸附的水气化后再试管口冷凝倒流炸裂试管,装置D是安全瓶作用是防止液体倒吸,
故答案为:a;e;f;c;bd;防止固体表面吸附的水气化后再试管口冷凝倒流炸裂试管;防止倒吸;
(2)加热时放出红棕色气体,装置A加热AgNO3固体,产生红棕色气体为二氧化氮,当反应结束后,试管中残留固体为黑色,可能为单质银或氧化银,银不能溶解于氨水溶液,Ag2O能溶于氨水中形成银氨溶液,可以验证固体成分的判断,加入足量氨水,振荡黑色固体不溶解,说明生成的固体为Ag,硝酸与Ag反应生成NO气体,有气体生成说明固体中含有Ag,硫酸能溶解氧化银,金属银不与硫酸反应,可以验证固体成分,所以鉴别黑色固体不能选择的试剂是氢氧化钠,
故答案为:a;
(3)带火星的木条遇到氧气会复燃,当装置中的空气排尽时,收集产生的气体,并用带火星的木条检验.若能收集到O2,则现象为木条复燃,若不能收集到O2,则现象为木条不复燃,因为分解生成的二氧化氮和氧气若按照4:1全部溶于水反应生成硝酸,硝酸和氢氧化钠溶液反应,反应的化学方程式为:4NO2+O2+4NaOH=4NaNO3+2H2O,
故答案为:木条复燃;木条不复燃;4NO2+O2+4NaOH=4NaNO3+2H2O;
(4)利用0.1mol•L-1AgNO3溶液和同浓度、同体积的0.1mol/LNaCl溶液和NaI溶液,先分别取5ml0.1mol/LNaCl溶液和NaI溶液充分混合,然后逐滴滴入0.1mol/LAgNO3溶液,若先析出黄色沉淀,则Ksp(AgCl)>Ksp(AgI),若先析出白色沉淀则Ksp(AgCl)<Ksp(AgI),
故答案为:先分别取5ml0.1mol/LNaCl溶液和NaI溶液充分混合,然后逐滴滴入0.1mol/LAgNO3溶液,若先析出黄色沉淀,则Ksp(AgCl)>Ksp(AgI),若先析出白色沉淀则Ksp(AgCl)<Ksp(AgI).
点评 本题考查了实验设计的方法和物质实验验证方案分析判断,物质性质的应用是解题关键,题目难度中等,侧重于考查学生的对基础知识的应用能力和计算能力.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定温度压强下,将H2和N2充入一体积为2L的密闭容器中.反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是( )
在一定温度压强下,将H2和N2充入一体积为2L的密闭容器中.反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是( )| A. | 从曲线可以看出,反应进行到10 min时,改变的条件可能是降低温度 | |
| B. | 反应开始到第一次平衡,NH3的平均反应速率为0.005 mol/(L min) | |
| C. | 从曲线可以看出,反应进行到25min时,改变的条件是分离出0.1mol的氨气 | |
| D. | 在25 min时平衡正向移动但达到新平衡后NH3的物质的量百分含量比原来小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
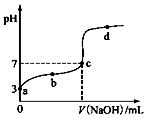 某温度时,CH3COOH电离的平衡常数为K.该温度下向20mL0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图(忽略温度变化).下列说法不正确的是( )
某温度时,CH3COOH电离的平衡常数为K.该温度下向20mL0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图(忽略温度变化).下列说法不正确的是( )| A. | a点表示溶液c(CH3COO-)=10-3 mol•L-1 | |
| B. | b点表示溶液c(CH3COO-)>c( Na+) | |
| C. | c点表示溶液c(CH3COO-)=c( Na+),此时,CH3COOH和NaOH恰好完全中和 | |
| D. | b、d点时CH3COOH的电离平衡常数K均为1.0×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氨气是一种重要的工业产品,也是一种重要的化工原料.为研究氨气的制备及性质,某学习小组进行了下面的探究活动:
氨气是一种重要的工业产品,也是一种重要的化工原料.为研究氨气的制备及性质,某学习小组进行了下面的探究活动:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
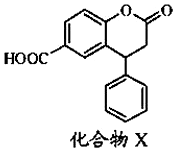
| A. | X的分子式为C16H11O4 | |
| B. | X分子中有3种不同的官能团 | |
| C. | X分子中3个六元环可能处于同一平面 | |
| D. | 即能发生酯化反应,又能发生水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com