
| A、c (Ac-)>c (Cl-)>c (H+)>c (HAc) |
| B、c (Ac-)>c (Cl-)>c (HAc)>c(H+) |
| C、c (Ac-)=c (Cl+)>c (H+)>c (HAc) |
| D、c (Na+)+c (H+)=c (Ac-)+c (Cl-)+c (OH-) |


科目:高中化学 来源: 题型:
| A、水电离产生的c(H+)=10-12的溶液:K+、Na+、ClO-、I- |
| B、c(H+)/c(OH-)=10-12的溶液:K+、AlO2-、CO32-、Na+ |
| C、硫化钠溶液:Cu2+、SO32-、Br-、H+ |
| D、pH=13的溶液:AlO2-、Cl-、HCO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
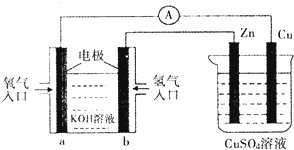
| A、该装置中Cu极为正极 |
| B、当铜极的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为2.24L |
| C、一段时间后锌片质量减少 |
| D、B极反应的电极反应式为:H2-2e-=2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 关于如图实验的叙述正确的是( )
关于如图实验的叙述正确的是( )| A、X为Cl2.生成Cl2的电极反应:2Cl-→Cl2↑+2e- |
| B、阴极材料必须使用铂做电极 |
| C、在电解过程中,阴极附近的滴液会先呈现红色 |
| D、电解饱和食盐水的化学反应方程式:2NaCl+2H2O=Cl2↑+H2↑+2NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
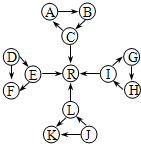 某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):
某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
| B、钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ |
| C、氢氧化亚铁溶于稀硝酸中:Fe(OH)2+2H+=Fe2++2H2O |
| D、澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHS溶液水解的方程式为:HS-+H2O?S2-+H3O+ | ||||
| B、向H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ | ||||
| C、在100 mL 2 mol/L FeBr2溶液中通入4.48 L氯气(标况下),充分反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | ||||
D、用惰性电极电解饱和氯化钠溶液:2Cl-+2H+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
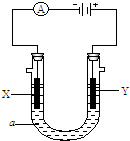 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com