
| A. | pH=5的NH4Cl溶液或醋酸溶液中,由水电离出的c(H+)均为10-9mol•L-1 | |
| B. | 常温下,将pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| C. | 在c(H+):c(OH-)=1:l012的溶液中,Na+、I-、NO3-、SO42-能大量共存 | |
| D. | 0.1 mol•L-1 Na2CO3溶液和0.1 mol•L-1 NaHSO4溶液等体积混合,溶液中:c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
分析 A、酸溶液中酸电离产生的H+抑制水的电离,盐溶液中盐水解时促进水的电离;
B、常温下,将pH=3的醋酸和pH=11的NaOH溶液等体积混合后得到CH3COONa和剩余CH3COOH的混合溶液,呈酸性;
C、在c(H+):c(OH-)=1:l012<1,c(H+)<c(OH-),溶液呈强碱性;
D、根据电荷守恒,0.1 mol•L-1 Na2CO3溶液和0.1 mol•L-1 NaHSO4溶液等体积混合,溶液中:c(Na+)+c(H+)=2c(CO32-)+2c(SO42-)+c(HCO3-)+c(OH-).
解答 解:A、醋酸溶液中酸电离产生的H+抑制水的电离,NH4Cl溶液中铵根离子的水解时促进水的电离,所以水电离出的c(H+)均为10-5mol•L-1,故A错误;
B、常温下,将pH=3的醋酸和pH=11的NaOH溶液等体积混合后得到CH3COONa和剩余CH3COOH的混合溶液,呈酸性,所以pH<7,故B错误;
C、在c(H+):c(OH-)=1:l012<1,c(H+)<c(OH-),溶液呈强碱性,而强碱性,Na+、I-、NO3-、SO42-能大量共存,故C正确;
D、根据电荷守恒,0.1 mol•L-1 Na2CO3溶液和0.1 mol•L-1 NaHSO4溶液等体积混合,溶液中:c(Na+)+c(H+)=2c(CO32-)+2c(SO42-)+c(HCO3-)+c(OH-)故D错误;
故选C.
点评 本题考查离子浓度大小的比较,学生要结合弱离子的水解对水的电离起促进,以及守恒知识在解题中的应用,比较容易.


科目:高中化学 来源: 题型:解答题

 都是平面型分子
都是平面型分子查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,D的核磁共振氢谱图中将出现4种峰;
,D的核磁共振氢谱图中将出现4种峰; ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
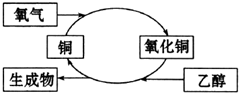
| A. | 生成物是乙醛 | B. | 乙醇发生了还原反应 | ||
| C. | 铜是此反应的催化剂 | D. | 反应中有红黑颜色交替变化的现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
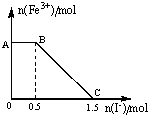 将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列有关说法不正确的是( )
将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列有关说法不正确的是( )| A. | 图中AB段发生的是过量的酸性KMnO4溶液与KI的反应 | |
| B. | 从题中可以得出还原性:I->Fe2+>Mn2+ | |
| C. | 取B点以后的少量溶液滴入几滴KSCN溶液,溶液变红色 | |
| D. | 根据OC段的数据可知,开始加入的KMnO4的物质的量为0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
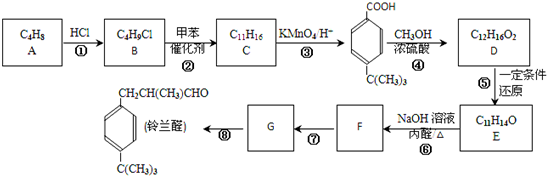
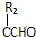
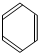 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$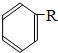 +HCl(R、R1、R2均为烃基)
+HCl(R、R1、R2均为烃基)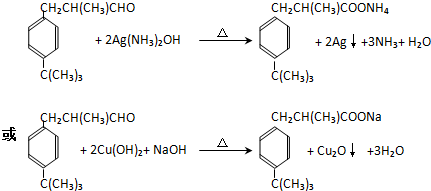 .
. .
.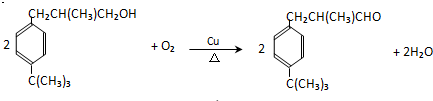 .
.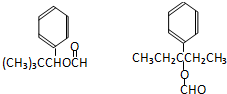 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
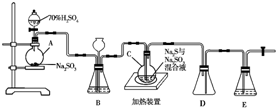 工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程.烧瓶C中发生反应如下:
工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程.烧瓶C中发生反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z | ||
| T |
| A. | 原子半径:T>W>Z | |
| B. | 元素T与X的原子序数相差15 | |
| C. | T、Z、W三种元素的最高价氧化物对应的水化物的酸性依次减弱 | |
| D. | X、W两元素的氢化物的浓溶液相互靠近时有白烟产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com