
【题目】A~G是几种烃的分子球棍模型(如图),据此回答下列问题:
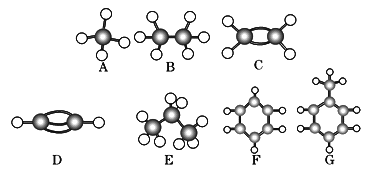
(1)常温下含碳量最高的气态烃是 (填字母).
(2)能够发生加成的烃有 种.
(3)一卤代物种类最多的是 (填写字母).
(4)写出实验室制D的化学方程式 .
(5)写出F发生硝化反应的化学方程式 .
【答案】(1)D.
(2)4.
(3)G.
(4)CaC2+2H2O→Ca(OH)2+C2H2↑.
(5)![]() +HNO3(浓)
+HNO3(浓)![]()
![]() +H2O.
+H2O.
【解析】试题分析:(1)常温下,分子中含有碳原子个数不大于4的烃为气态烃,根据其球棍模型判断,分子中含有碳氢原子个数比最大即为含碳量最高的.
(2)含有碳碳双键或三键或苯环的烃能发生加成反应.
(3)根据烃的球棍模型确定一卤代烃的同分异构体种类.
(4)实验室用碳化钙和水反应制取乙炔.
(5)苯和硝酸在浓硫酸作催化剂、加热条件下制取硝基苯.
解:(1)常温下,分子中含有碳原子个数不大于4的烃为气态烃,根据其球棍模型判断,分子中含有碳氢原子个数比最大即为含碳量最高的,所以含碳量最大的是乙炔.
故答案为:D.
(2)含有碳碳双键或三键或苯环的烃能发生加成反应,所以乙烯、乙炔、苯和甲苯都能发生加成反应,所以是4种.
故答案为:4.
(3)甲烷、乙烷、乙烯、乙炔、苯的一卤代物都只有1种,丙烷的一卤代物有2种,甲苯的有一卤代物有4种,
故答案为:G.
(4)实验室用碳化钙和水反应制取乙炔,反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑.
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑.
(5)在浓硫酸作催化剂、加热条件下苯和浓硝酸反应生成硝基苯,反应方程式为:![]() +HNO3(浓)
+HNO3(浓)![]()
![]() +H2O.
+H2O.
故答案为:![]() +HNO3(浓)
+HNO3(浓)![]()
![]() +H2O.
+H2O.


科目:高中化学 来源: 题型:
【题目】将12mol/L的盐酸(ρ=1.19g/cm3)50mL稀释成6mol/L的盐酸(ρ=1.10g/cm3),需加水的体积为
A. 50mL B. 50.5mL C. 55mL D. 59.5mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂和产物略去):

已知:I. 
II. 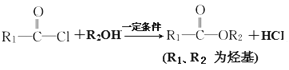
(1)G的名称________
(2)已知E能发生水解反应,则X的结构简式________
(3)C→D的反应类型是_______
(4)光刻胶的结构简式_______________________
(5)B→C第①步反应的化学方程式为_____________________
(6)H与C的分子式相同。满足下列条件的H的结构有_______种。
①分子结构中只有一个羟基,能与FeCl3溶液发生显色反应
②不能发生银镜反应
③分子中除苯环外无其它环状结构
(7)结合以上信息写出以A为原料制备丙三醇的合成路线流程图(其它试剂任选)。______________
合成路线流程图示例如下:CH3CHO![]() CH3COOH
CH3COOH ![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中,产生NO的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是 ( )
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是 ( )

A. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 温度T下,该反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A﹣G是初中化学中常见的物质,其相互反应及转化关系如图所示,部分反应条件省略.已知A是易与人体血红蛋白结合的有毒气体,B是赤铁矿的主要成分,C是相对分子质量最小的氧化物,F是最轻的气体.

(1)G的化学式为____________。
(2)写出相应反应的化学方程式:①____________。②____________。
(3)反应③的实验现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有色金属研究室对从银锰精矿中提取单质银的方法进行改良创新,从而更高效地实现锰和银的分离。其简易流程如下图。已知:银锰精矿主要成分为MnO2和银单质。
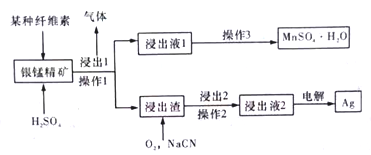

(1)操作1与操作2所对应的分离方法是__________________。
(2)通过对“浸出1”步骤中纤维细度的控制,绘制出一定时间内纤维素-Mn浸出率图象如上图所示,实际生产中应控制细度________mm较为合适,理由是_________。
(3)在“浸出1”步骤中,纤维素会先水解为单糖,请写出该单糖(用分子式表达)与银锰精矿反应的离子方程式:_______________________。
(4)浸出液2的主要成分为[Ag(CN)2]-,使用情性电极电解浸出液2,请写出阴极的电极方程式:________。本流程中可循环使用的物质为_________________。
(5)通过上述流程,浸出液1中通常还含有少量银离子,充分提取银,可对MnSO4·H2O晶体进行洗涤,请简述洗涤的方法_____________________________。将洗涤液与母液合并,加入盐酸,过滤后再经过以下步骤可回收大部分浸出液1中的银。试剂a是______________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各关系式中能说明反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.光照新制的氯水时,溶液的pH逐渐减小
B.氨水应密闭保存于低温处
C.打开汽水瓶时,有大量气泡逸出
D.高温高压有利于N2和H2转化为NH3:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。

下列说法不正确的是
A. 溶液中H+的移动方向由A极到B极
B. 电池总反应方程式为:2SO2 + O2 + 2H2O = 2H2SO4
C. 正极电极反应式为:SO2+ 2H2O-2e=SO4 2+4H+
D. 当有0.25mol SO2被吸收时,通过H+交换膜的H+的物质的量为0.5mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com