
| A. | 粗铜板作阳极 | |
| B. | 电解时,阴极反应为Cu2++2e-=Cu | |
| C. | 电解铜的纯度可达99.95%~99.95% | |
| D. | 粗铜中所含的锌、镍、银等,电解后均以单质形式沉积槽底 |
分析 精炼粗铜,粗铜为电解池的阳极,阳极上比Cu活泼的金属及Cu失去电子,主要发生Cu-2e-=Cu2+,纯铜为电解池的阴极,电极反应为Cu2++2e-=Cu,以此解答该题.
解答 解:A.粗铜为电解池的阳极,故A正确;
B.纯铜为电解池的阴极,电极反应为Cu2++2e-=Cu,故B正确;
C.阴极只有铜离子得到电子,电解铜的纯度可达99.95%~99.95%,故C正确;
D.粗铜中所含的锌、镍等失去电子,而银等在电解后以单质形式沉积槽底形成阳极泥,故D错误;
故选D.
点评 本题考查电解原理及应用,为高频考点,把握粗铜精炼的原理、电极反应为解答的关键,侧重分析与应用能力的考查,注意阳极泥的判断,题目难度不大.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 该原子的摩尔质量是aNA | |
| B. | mg该原子中含有aNA个原子 | |
| C. | mg该原子的物质的量一定是$\frac{m}{a{N}_{A}}$mol | |
| D. | 阿伏加德罗常数NA=$\frac{12}{α}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
| 实验 编号 | 铜片 质量/g | 0.1mol•L-1 硝酸/mL | 硝酸铜 溶液/mL | 亚硝酸钠 溶液/mL | 水的体积 /mL | 实验目的 |
| ① | 5 | 20 | 0 | 0 | 0.5 | 实验①和②探究Cu2+对实验的影响;实验①和③探究亚硝酸根的影响. |
| ② | 5 | 20 | 0.5 | 0 | 0 | |
| ③ | 5 | 20 | 0 | X | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用瘦肉精饲养的猪 | B. | 用着色剂染色的馒头 | ||
| C. | 用硫酸铜浸泡过粽叶的粽子 | D. | 用食盐水浸泡过的菠萝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大 | |
| B. | 0.2 mol/LNH4NO3 和 0.l mol/L NaOH 溶液等体积混合后:c(NH4+)>c (NO3-)>c (Na+)>c (OH-)>c (H+) | |
| C. | 物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:c (Na+)+c(H+)=c (CH3COO-)+c (OH-)+c (CH3COOH) | |
| D. | 同浓度的下列溶液:①NH4Al(SO4)2②NH4Cl ③NH3•H2O ④CH3COONH4,其中c(NH4+) 由大到小的顺序是:①>②>④>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
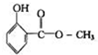 冬青油结构如图,它在一定条件下能发生的反应有:( )
冬青油结构如图,它在一定条件下能发生的反应有:( )| A. | ①②⑥ | B. | ①②③ | C. | ④⑤⑥ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①⑥ | C. | ③④⑤ | D. | ①②⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com