
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
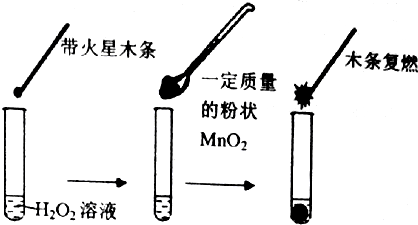
分析 (1)要证明MnO2是H2O2分解反应的催化剂,必须证明催化剂在反应前后的性质和质量不改变;
(2)从所给的数据可知:试管Ⅰ、试管Ⅱ所用试剂的浓度、用量完全一样,产生气泡的快慢不一样,说明不同催化剂对反应的催化效果不一样,要对比Fe3+和Cu2+对H2O2分解反应的催化效果,必须排除溶液中的阴离子是否有催化作用,试管Ⅲ就很好的解决了这个问题;
(3)根据化合价的升降和催化剂会参加反应,但最终性质和质量不改变写出反应方程式.
解答 解:(1)要证明MnO2是H2O2分解反应的催化剂,必须证明催化剂在反应前后的性质和质量不改变,而甲同学没有做这方面的实验,所以不能达到目的,
故答案为:不能;因为没有确认MnO2的质量和性质是否改变;
(2)从所给的数据可知:试管Ⅰ、试管Ⅱ所用试剂的浓度、用量完全一样,产生气泡是试管Ⅰ快,试管Ⅱ慢,试管Ⅲ无气泡产生,试管Ⅲ是一个对比实验,说明Cl-对H2O2的分解没有催化作用,从而得到Fe3+和Cu2+对H2O2的分解均有催化作用,且Fe3+比Cu2+催化效果好的结论,
故答案为:Fe3+和Cu2+对H2O2的分解均有催化作用,且Fe3+比Cu2+催化效果好;对比实验,证明Cl-对H2O2的分解没有催化作用;
(3)根据化合价的升降和催化剂会参加反应,但最终性质和质量不改变写出反应方程式,FeCl3和H2O2反应,FeCl3中铁元素化合价降低,生成氯化亚铁,双氧水中氧元素化合价升高,生成氧气,方程式为:2FeCl3+H2O2=2FeCl2+O2↑+2HCl;FeCl3作催化剂,在第二个反应中重新生成,氯化亚铁又被双氧水氧化成氯化铁,方程式为:2FeCl2+H2O2+2HCl=2FeCl3+2H2O,
故答案为:2FeCl3+H2O2=2FeCl2+O2↑+2HCl; 2FeCl2+H2O2+2HCl=2FeCl3+2H2O.
点评 本题考查了催化剂在反应中起到的作用,以及催化剂的质量大小对反应速率的影响探究,侧重考查学生的分析能力和实验能力,并考查了对比实验的重要性,结合催化剂的特点分析催化机理,并对方程式进行推导,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体颜色变浅 | B. | 逆反应速率加快 | ||
| C. | NO2转化率增大 | D. | 气体平均分子量变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径:X>Y,离子半径:X3+>Y2- | |
| C. | 同族元素中Y的氢化物稳定性最高 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从开始到平衡,A的反应速率为0.08mol•L-1•min-1 | |
| B. | 随着反应的进行,混合气体的密度逐渐减小 | |
| C. | 达到平衡时,B的转化率为20% | |
| D. | 该温度下,反应的平衡常数K=$\frac{20}{3}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com