
科目:高中化学 来源:不详 题型:单选题
| A.铜片溶解,生成物冷却后加水稀释溶液成蓝色 |
| B.生成的气体体积为1.12L |
| C.参加反应的硫酸与被还原的硫酸物质的量之比为2:1 |
| D.该实验中可用Na2CO3溶液处理尾气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
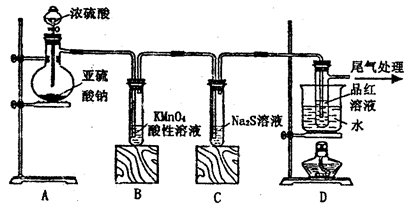
 +□H2O=□
+□H2O=□ +□
+□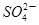 +□H+;
+□H+;查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 ___________________________________________________ | _________________________ ______________________________________________ |
| 步骤3:_______ _______________________ ___________________________________________________ | _________________________ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取反应后的固体放入试管中,…… | |

| SO2被氧化的程度 | V与m1或m2的关系 |
| 完全被氧化 | V=0 |
| 部分被氧化 | |
| 未被氧化 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
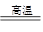 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2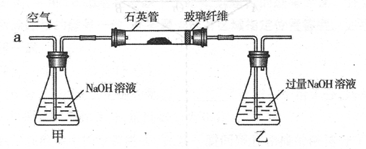
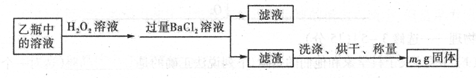
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 资料:① H2S可溶于水(约1:2),其水溶液为二元弱酸。 ② H2S可与许多金属离子反应生成沉淀。 ③ H2S在空气中燃烧,火焰呈淡蓝色。 |
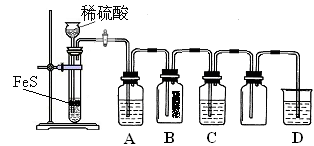
| | 实验操作 | 实验现象 |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
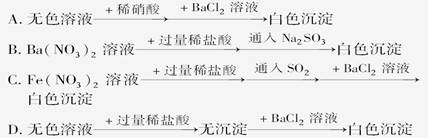
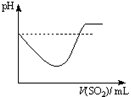 | 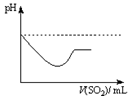 | 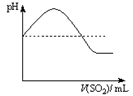 | 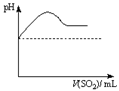 |
| A | B | C | D |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
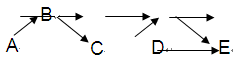
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com