
(选考)【化学——有机化学基础】(15分)
有机物A是常用的食用油抗氧化剂,分子为C10H12O5,可发生如下变化:
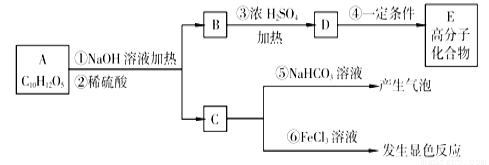
已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为: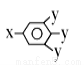 (其中-x、-y均为官能团)。请回答下列问题:
(其中-x、-y均为官能团)。请回答下列问题:
(1)根据系统命名法B的名称为 。
(2)官能团-x的名称为 ,高聚物E的链节为 。
(3)A的结构简式为 。
(4)反应⑤的化学方程式为 。
(5)C有多种同分异构体,写出其中2种符合下列要求的同分异构体的结构简式 、 。
①含有苯环 ②能发生银镜反应 ③含有酚羟基
(6)从分子结构上看,A具有抗氧化作用的主要原因是 (填序号)。
A.含有苯环 B.含有羰基 C.含有酚羟基
(1)1—丙醇 (2)羧基; (3)
(3)
(4)
(5) (任写2种)
(任写2种)
(6)
【解析】
试题分析:A在氢氧化钠溶液中水解生成B和C,根据A的分子式可知A是酯类。C能与碳酸氢钠反应产生气泡,说明含有羧基,也能与氯化铁溶液发生显色反应,说明还含有酚羟基。已知B的相对分子质量为60,分子中只含一个甲基,所以B是正丙醇。B在浓硫酸的作用下发生消去反应生成D,则D是丙烯,结构简式为CH3CH=CH2。丙烯发生加聚反应生成高分子化合物F,则F的结构简式为 。C的结构可表示为:
。C的结构可表示为: ,根据A和B的分子式可知C分子中含有7个碳原子,所以C的结构简式为
,根据A和B的分子式可知C分子中含有7个碳原子,所以C的结构简式为 ,则A的结构简式为
,则A的结构简式为 。
。
(1)根据B的结构简式可知,B的名称为1—丙醇。
(2)根据C的结构简式可知官能团-x的名称为羧基;高聚物E的链节为 。
。
(3)根据以上分析可知A的结构简式为 。
。
(4)根据以上分析可知反应⑤的化学方程式为
 。
。
(5)①含有苯环;②能发生银镜反应,说明含有醛基;③含有酚羟基,则符合条件的有机物结构简式为

(6)酚羟基易被氧化,所以从分子结构上看,A具有抗氧化作用的主要原因是含有酚羟基,答案选C。
考点:考查有机化学基础模块的分析与应用


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015甘肃省白银市高二上学期期末化学试卷(解析版) 题型:选择题
下列离子方程式中,属于水解反应的是
A.HCOOH+H2O HCOO-+ H3O+ B.CO2+H2O
HCOO-+ H3O+ B.CO2+H2O HCO3- + H+
HCO3- + H+
C.CO32- + H2O HCO3- + OH- D.HS- + H2O
HCO3- + OH- D.HS- + H2O S2- + H3O
S2- + H3O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省天一高三上学期大联考化学试卷(解析版) 题型:选择题
用表示阿伏加德罗常数的值。下列叙述中不正确的是
A.16.9 g过氧化钡(BaO2)加入足量H2O中转移电子数目为0.1NA
B.常温常压下,28 g乙烯含有的电子数为16 NA
C.标准状况下,ag某气体含分子数为b,则cg该气体的体积为22.4bc/ NA a L
D.1 mol丙烷分子中含有的共用电子对数为8 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省邯郸市高三上学期1月教学质量检测化学试卷(解析版) 题型:选择题
已知某温度下,Ksp(AgCl)=1.56×10-10 mol2·L-2,Ksp(Ag2CrO4)=1.12×10-12 mol3·L-3,下列叙述正确的是
A.向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小
B.向2.0×10-4 mol·L-1的K2CrO4溶液中加入等体积的2.0×10-4 mol·L-1 AgNO3 溶液,则有Ag2CrO4沉淀生成
C.将一定量的AgCl和Ag2CrO4固体混合物溶于蒸馏水中,充分溶解后,静置,上层清液中Cl-的物质的量浓度最大
D.将0.001 mol·L-1的AgNO3 溶液逐滴滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4的混合溶液中,则先产生AgCl沉淀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省邯郸市高三上学期1月教学质量检测化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱
B.漂白粉和明矾都常用于自来水的处理,二者的作用原理不相同
C.将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀
D.过量的铜与浓硝酸反应,生成的气体只有NO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高三上学期期末理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,2.24L SO3含有的分子数为0.1NA
B.常温下,3.0g甲醛含有C-H键数目为0.2NA
C.含有2molH2SO4的浓硫酸与足量Cu加热条件充分反应,电子转移数是2NA
D.1L 1mol/L AlCl3溶液含Al3+数目为NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三上学期期末化学试卷(解析版) 题型:实验题
(12分)某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示。

(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A。 |
FeCl3溶液显酸性的原因是_________。写出装置A中产生SO2的化学方程式:_________。
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:_____________________。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:______________________________。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验。
步骤② | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
步骤③ | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为_______________。
(4)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III._________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
下列关于材料的说法中,正确的是
A.光导纤维是信息社会必不可少的有机合成材料
B.棉布、羊毛和涤纶燃烧后都只生成二氧化碳和水
C.航天飞机上的陶瓷防护片属于新型无机非金属材料
D.食品保鲜膜、塑料水杯等生活用品的主要成分是聚氯乙烯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省部分高三1月份统一考试理综化学试卷(解析版) 题型:推断题
【化学一有机化学基础】(15分)直接生成碳-碳键的反应是实现高效、绿色有机合成的重要途径。交叉脱氢偶联反应是近年备受关注的一类直接生成碳-碳键的新反应。例如:

化合物Ⅰ可由以下合成路线获得:

(1)化合物Ⅰ的分子式为___________,其在NaOH溶液中水解的化学方程式为_____。
(2化合物Ⅱ与足量浓氢溴酸反应的化学方程式为_________________________________。
(3化合物Ⅲ没有酸性,其结构简式为___________________;Ⅲ的一种同分异构体Ⅴ能与饱和NaHCO3溶液反应放出CO2,化合物Ⅴ的结构简式为______________________________。
(4)反应①中1个脱氢剂Ⅵ(结构简式如 )分子获得2个氢原子后,转变成1个芳香族化合物分子,该芳香族化合物分子的结构简式为________________________。
)分子获得2个氢原子后,转变成1个芳香族化合物分子,该芳香族化合物分子的结构简式为________________________。
(5)1分子 与1分子
与1分子 在一定条件下可发生类似反应①的反应,其产物分子的结构简式为______________________;1mol该产物最多可与______molH2发生加成反应。
在一定条件下可发生类似反应①的反应,其产物分子的结构简式为______________________;1mol该产物最多可与______molH2发生加成反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com