
| A. | 大力推广燃煤发电以满足工业发展的用电需求 | |
| B. | 加强生活污水的除磷处理,遏制水体的富营养化 | |
| C. | 实施化石燃料脱硫硝技术,减少大气污染物的排放 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
分析 A.煤为非再生资源,且燃烧过程中会产生大量硫、氮的氧化物;
B.天然水体中由于过量营养物质(主要是指氮、磷等)的排入,引起各种水生生物、植物异常繁殖和生长,这种现象称作水体富营养化;
C.大力实施矿物燃料“脱硫、脱硝技术”,可减少硫氧化物和氮氧化物的污染,减少酸雨、光化学烟雾等污染;
D.利用CO2合成聚碳酸酯类可降解塑料,减少二氧化碳的排放.
解答 解:A.煤为非再生资源,且推广燃煤发电,会加重环境的污染,故A错误;
B.大量含有各种含氮和磷有机物的废污水排入水中,促使水域富营养化,加强城市生活污水脱氮除磷处理,可遏制水体富营养化,故B正确;
C.硫的氧化物和氮的氧化物污染空气,实施矿物燃料“脱硫、脱硝技术”,可减少污染物的产生,故C正确;
D.利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用应用,减少二氧化碳的排放,符合题意,故D正确;
故选A.
点评 本题考查化学环境污染与治理的相关知识,题目难度不大,侧重于化学与生活、生产以及环境的考查,为高考高频考点,有利于培养学生的良好科学素养和学习的积极性,注意掌握常见环境污染类型、危害及治理方法,试题培养了学生的灵活应用能力.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
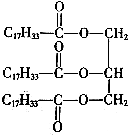 ).在食用油的使用过程中,如果忘记盖上盖子,时间一长,食用油就会有一股特殊的气味-“哈喇”味.下列说法不正确的是( )
).在食用油的使用过程中,如果忘记盖上盖子,时间一长,食用油就会有一股特殊的气味-“哈喇”味.下列说法不正确的是( )| A. | 油酸甘油酯是一种不饱和高级脂肪酸甘油酯 | |
| B. | 油酸甘油酯可以使酸性高锰酸钾溶液褪色 | |
| C. | 1mol油酸甘油酯完全水解可以得到3mol C17H33COOH | |
| D. | 食用油变味是由于食用油发生了水解产生了甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 解释或结论 |
| A | 用容量瓶配制溶液时,定容后摇匀 | 液面低于刻度线 | 浓度一定偏高 |
| B | 燃着的镁条深入盛CO2的集气瓶中 | 镁条继续燃烧 | 镁有比较强的还原性 |
| C | 分别向酸性KMnO4溶液中加入FeCl2或通入SO2 | 酸性KMnO4溶液颜色均褪去 | Fe2+具有还原性,SO2具有漂白性 |
| D | 过量Fe粉加入稀HNO3中,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
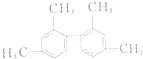
| A. | 等质量的该烃和甲烷均完全燃烧,耗氧量后者小于前者 | |
| B. | 该烃能使酸性高锰酸钾溶液褪色,属于苯的同系物 | |
| C. | 分子中一定有11个碳原子处于同一平面上 | |
| D. | 该烃的一氯取代产物为6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
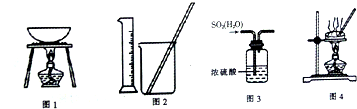
| A. | 用图1所示装置从KI和I2的固体混合物中回收I2 | |
| B. | 用图2所示装置配制100mL0.10mol•L-1 K2Cr2O7溶液 | |
| C. | 用图3所示装置干燥少量的SO2的气体 | |
| D. | 用图4所示装置蒸干FeCl3饱和溶液制备FeCl3晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 英国《自然》杂质近期报道了一种用泡沫石墨烯(CW)作为正极材料的新型铝离子电池,其放电时的工作原理如图所示,下列说法不正确的是( )
英国《自然》杂质近期报道了一种用泡沫石墨烯(CW)作为正极材料的新型铝离子电池,其放电时的工作原理如图所示,下列说法不正确的是( )| A. | 放电时,若外电路中转移1mol电子,则负极质量减少9g | |
| B. | 充电时,石墨烯作阳极 | |
| C. | 充电时,阴极的电极反应式为AlCl4-+3e-═Al+4Cl- | |
| D. | 放电时,正极的电极反应式为CW(AlCl4)+e-═CW+AlCl4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向转动 | B. | 平衡不移动 | ||
| C. | C的百分含量增大 | D. | C的百分含量减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| 使用填埋法处理未经分类的生活垃圾 | 食用油脂能促进人体对某些维生素的吸收 | 利用二氧化碳可制造全降解塑料,有利于缓解温室效应 | 药皂中的少量苯酚,可起到杀菌消毒的作用 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com