
分析 (1)空气中的氮气在放电或高温下反应生成NO;
(2)NO与空气的主要成份氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸和一氧化氮;
(3)CaCO3粉末与酸反应生成氯化钙、水和二氧化碳来消除酸雨对水质的影响.
解答 解:(1)空气中的氮气在放电或高温下反应生成NO,该反应为N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,故答案为:在放电时空气中的N2和O2反应NO,N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;
(2)NO与空气的主要成份氧气反应生成二氧化氮,反应方程式为:2NO+O2═2NO2,二氧化氮与水反应生成硝酸和一氧化氮,反应方程式为:3NO2+H2O═2HNO3+NO,所以NO对大气的影响之一是导致酸雨,故答案为:2NO+O2═2NO2、3NO2+H2O═2HNO3+NO;
(3)CaCO3粉末与酸反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,故答案为:CaCO3+2H+═Ca2++CO2↑+H2O.
点评 本题考查了酸雨的成因、性质和治理等,难度不大,注意积累.


科目:高中化学 来源: 题型:解答题
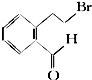 下面的框图是应用2-(2-溴乙基)苯甲醛为原料合成有机化合物C和F的流程图:
下面的框图是应用2-(2-溴乙基)苯甲醛为原料合成有机化合物C和F的流程图: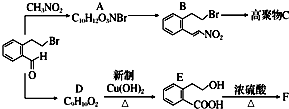
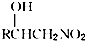
 .
.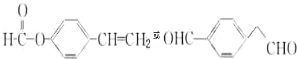 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
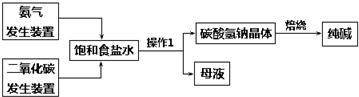
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X一种核素在考古时常用来坚定一些文物的年代 |
| Y | Y基态原子的s轨道电子与P轨道电子数相等 |
| Z | Z是所在周期的单核离子中半径最小 |
| W | W的单质被誉为“信息革命的催化剂”常用做半导体材料 |
| T | T有多种氧化物,其中一种纯净的氧化物可用来作录音磁带和 电讯器材的原材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
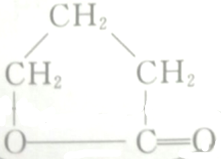 的各步反应方程式:
的各步反应方程式: +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电子式表示氢溴酸的形成过程为: | |
| B. | 海水中Br-的电子式为: | |
| C. | 海水中通入氯气时发生反应的离子方程式为:2Br-+Cl2=Br2+2Cl- | |
| D. | Cl-的结构示意图为: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com