
【题目】写出下列物质的电子式:
(1)CaCl2:___;Na2S:___;HCl:___。
写出下列物质的结构式:
(2)HClO:___;CO2:___;N2:___。
写出下列物质的结构示意图:
(3)Ca:___;Mg2+:___;F-:___。
【答案】![]()
![]()
![]() H-O-Cl O=C=O N≡N
H-O-Cl O=C=O N≡N 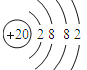
![]()
![]()
【解析】
(1)CaCl2是离子化合物,Ca2+与Cl-之间通过离子键结合;Na2S是离子化合物,Na+与S2-之间通过离子键结合;HCl是共价化合物,H原子与Cl原子之间通过共价键结合;
(2)HClO中O原子分别与H原子、Cl原子各形成1个共价键;CO2中C原子与2个O原子分别形成2个共价键;N2中2个N原子形成3个共价键;
(3)Ca是20号元素,根据原子核外电子排布规律书写其原子结构示意图;Mg2+是Mg原子失去最外层2个电子形成的阳离子;F-是F原子获得1个电子形成的阴离子。
(1)CaCl2是离子化合物,Ca2+与2个Cl-之间通过离子键结合,电子式为:![]() ;
;
Na2S是离子化合物,2个Na+与S2-之间通过离子键结合,电子式为:![]() ;
;
HCl是共价化合物,H原子与Cl原子之间通过1个共价键结合,电子式为:![]() ;
;
(2)在HClO分子中,O原子分别与H原子、Cl原子各形成1个共价键,使分子中H原子达到最外层2个电子的稳定结构,O原子和Cl原子达到最外层8个电子的稳定结构,其结构式是H-O-Cl;
在CO2分子中,C原子与2个O原子分别形成2个共价键,从而使分子中每个原子都达到最外层8个电子的稳定结构,其结构式是:O=C=O;
N2分子中2个N原子形成3个共价键,使分子中2个N原子都达到最外层8个电子的稳定结构,其结构式是:N≡N;
(3)Ca是20号元素,原子核外电子排布为2、8、8、2,所以其原子结构示意图为: ;Mg是12号元素,原子核外电子排布为2、8、2,Mg2+是Mg原子失去最外层2个电子形成的阳离子,因此其离子结构示意图为:
;Mg是12号元素,原子核外电子排布为2、8、2,Mg2+是Mg原子失去最外层2个电子形成的阳离子,因此其离子结构示意图为:![]() ;
;
F是9号元素,原子核外电子排布为2、7,F-是F原子获得1个电子形成的阴离子,离子结构示意图为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关。下列说法正确的是
A.一次性医用外科口罩的核心功能层熔喷布是以纯净物聚丙烯为原料制成
B.高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来
C.在“新冠肺炎战疫”中,84消毒液和医用酒精都可以用来消毒,但不宜混合使用
D.纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年因钢铁锈蚀造成大量的损失。某城市拟用如图方法保护埋在弱碱性土壤中的钢质管道,使其免受腐蚀。关于此方法,下列说法正确的是( )
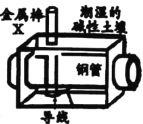
A.钢管附近土壤的pH小于金属棒附近土壤
B.钢管上的电极反应式为:O2+2H2O+4e-=4OH-
C.金属棒X的材料应该是比镁活泼的金属
D.也可以外接直流电源保护钢管,直流电源正极连接金属棒X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钼是重要的固体润滑剂,被誉为“高级固体润滑油之王”。利用低品相的辉钼矿(含MoS2、SiO2以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如图:
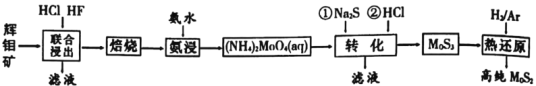
(1)(NH4)2MoO4中Mo的化合价为___。
(2)“焙烧”时MoS2转化为MoO3的化学方程式为___。
(3)“转化”中第一步加入Na2S后,(NH4)2MoO4转化为(NH4)2MoS4,写出第二步(NH4)2MoS4与盐酸生成MoS3的离子方程式为___。
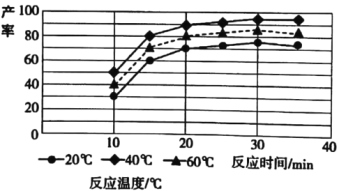
(4)由图分析可知产生MoS3沉淀的流程中选择的最优温度和时间是__,利用化学平衡原理分析低于或高于最优温度时,MoS3的产率均下降的原因___。
(5)利用低品相的原料制备高纯产品是工业生产中的普遍原则。如图所示,反应[Ni(s)+4CO(g)![]() Ni(CO)4(g)] ΔH<0在充满CO的石英管中进行,先在温度为T2的一端放入未提纯的粗镍粉末,一段时间后,在温度为T1的一端得到了纯净的镍粉,请结合平衡移动原理,判断温度Tl___T2(填“>”、“<”或“=”)。
Ni(CO)4(g)] ΔH<0在充满CO的石英管中进行,先在温度为T2的一端放入未提纯的粗镍粉末,一段时间后,在温度为T1的一端得到了纯净的镍粉,请结合平衡移动原理,判断温度Tl___T2(填“>”、“<”或“=”)。

(6)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8,不纯的Na2MoO4溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(忽略溶液体积变化),则当SO42-完全沉淀时,溶液中c(MoO42-)<___mol/L(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算:
3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算:
(1)5min末A的物质的量浓度为________。
(2)前5min内用B表示的化学反应速率v(B)为________。
(3)化学方程式中n值为________。
(4)此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol/(L·min)
②v(B)=6mol/(L·min)
③v(C)=4.5mol/(L·min)
④v(D)=8mol/(L·min)
其中反应速率最快的是________(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下反应的化学方程式或离子方程
(1)铝与氧化铁在高温下反应(铝热反应)______________;
(2)医学上,用(胃舒平)氢氧化铝治疗胃酸过多,写出反应的离子方程式____________;
(3)工业上用焦炭和二氧化硅反应制得粗硅(Si)______________;
(4)苯的硝化反应______________;
(5)乙醇和钠反应______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯甲烷等卤代烃跟苯的反应如图所示,(无机小分子产物略去)。下列说法正确的是

A. 该反应属于化合反应
B. b的二氯代物有6种结构
C. 1mol b加氢生成饱和烃需要6molH2
D. C5H11Cl的结构有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以甲苯为原料,合成抗癌药——拉帕替尼的中间体H的具体路线如下:
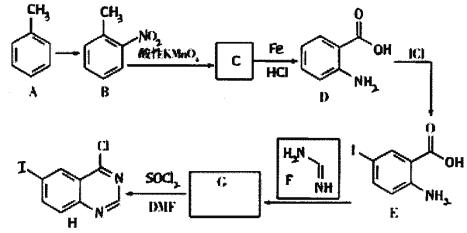
已知:①G的分子式为:C8H5N2OI
② ![]()
③![]()
回答下列问题:
(1)A→B的试剂和条件是__________;D→E的反应类型是________。
(2)C的结构简式为__________,其中含有的官能团名称为_____________。
(3)写出E→G反应的化学方程式________________。
(4)C有多种同分异构体,其中满足下列条件的同分异构体共有________种。①分子中含有苯环;②分子中含有—NO2且不含—O—NO2结构;③能发生银镜反应,其中核磁共振氢谱有3组峰,并且峰面积为1∶2∶2的有机物结构简式为____________。
(5)以硝基苯和有机物A为原料,设计路线合成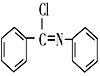 ,其他无机材料自选。___________。
,其他无机材料自选。___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上制备粗硅的反应SiO2+2C![]() Si+2CO↑能否说明C的非金属性强于Si?若能请说明理由;若不能请说明理由后,用一个化学方程式说明C的非金属性强于Si:____。
Si+2CO↑能否说明C的非金属性强于Si?若能请说明理由;若不能请说明理由后,用一个化学方程式说明C的非金属性强于Si:____。
(2)已知Mg2C3中阴阳离子的数目比为1:2,与水作用生成丙炔。写出Mg2C3的电子式____。
(3)固态氨基酸会显现出一些不同于一般有机物的性质,例如熔点较高,不易挥发,难溶于有机溶剂等。其主要原因是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com