
【题目】下列说法不正确的是( )
A.石油裂化可以提高汽油等轻质油的产量和质量
B.分子式为C5H12的同分异构体共有3种
C.向2mL碘水中加入1mL苯,振荡后静置,可观察到液体分层,上层呈紫红色
D.煤中含有苯和甲苯,可用干馏的方法将它们分离开来
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法正确的是( )

A.化合物RX中含共价键
B.化合物X2M是非电解质
C.M的单质在常温常压下为气体
D.Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分中学化学常见元素原子结构及性质如下表所示
元素 | 结构及性质 |
A | 元素A在第三周期中简单离子半径最小 |
B | B原子最外层电子数是内层电子数的0.6 |
C | 使用最广泛的金属元素C能形成两种氯化物,其相对分子质量之差为35.5 |
D | 元素D与B同主族,且大多数情况下D不显正化合价 |
E | 元素E在周期表中位于ⅠA族,有人认为将其排在ⅦA族也有一定道理 |
F | 元素F与B同周期,其最高价氧化物的水化物与A或B的最高价氧化物的水化物均能反应 |
(1)元素C在周期表中的位置是____元素;元素E形成的一种简单离子能支持“将元素E排在ⅦA族”这一观点,该离子的结构示意图为___。
(2)元素E与D可以按原子个数比2∶1、1∶1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为 __。E与B形成的一种化合物Z与X、Y中的一种电子总数相同且能发生化学反应,写出该反应的化学方程式:___(用相应化学式表示)。
(3)请画出化合物F2B2的电子式:_____,该化合物中含有的化学键类型是___。
(4)元素A与元素F相比,金属性较强的是_________ (用元素符号表示),下列表述正确且能证明这一事实的是___(填字母代号)。
a.对应单质与酸反应时,每个A原子比每个F原子失电子多
b.对应单质与同浓度盐酸反应时,F比A剧烈得多
c.A的氧化物熔点比F的氧化物熔点高
d.F可将A从其盐溶液中置换出来
e.最高价氧化物对应的水化物的碱性F比A的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示的原电池,下列说法正确的是( )
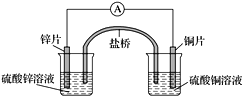
A. 电子从锌电极通过电流表流向铜电极
B. 盐桥中的阴离子向硫酸铜溶液中迁移
C. 铜电极发生还原反应,其电极反应是2H++2e-===H2↑
D. 取出盐桥后,电流表仍会偏转,铜电极在反应前后质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丰富多彩的生活材料:
(1)青奥会将于2014年8月在南京举行。青奥会建筑设施使用了大量节能材料,体现了“绿色青奥”的理念。
①用于青奥村工程的隔热保温材料聚氨酯属于___(填字母)。
a.有机高分子材料 b.无机非金属材料 c.金属材料
②青奥中心外墙的复合保温材料采用铝合金锁边。有关铝合金的性质正确的是___(填字母)。
a.强度小 b.耐腐蚀 c.密度大
③青奥会议中心双塔采用了玻璃幕墙设计。制造玻璃的主要原料为纯碱、石灰石和___(填字母)。
a.金刚砂 b.石英 c.水玻璃
(2)生活中处处有化学,化学己渗透到我们的“衣、食、住、行”之中。
①铝合金是生活中常见的材料,具有密度小、强度高的优良性能。其在空气中不易生锈的原因是___。
②玻璃和钢铁是常用的建筑材料。普通玻璃是由Na2SiO3、CaSiO3、___等物质组成的;钢铁制品不仅可发生化学腐蚀,在潮湿的空气中还能发生___腐蚀,生成的铁锈的主要成分是___(填化学式)。
(3)氮化硅是一种新型高温材料,可用于制造汽车发动机。请写出高纯硅和氮气在1300℃反应制备氮化硅的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a~n10中元素在周期表中的位置如图所示,请回答下列问题:
a | ||||||||
b | c | d | e | |||||
f | g | h | m | n | ||||
…… |
(1)m的阴离子的结构示意图为___。
(2)b的最高价氧化物的化学式为___;用化学方程式表示f、d的单质形成f2d2的过程___。
(3)d、g、n形成的简单离子的半径由大到小的顺序为___(用离子符号表示)。
(4)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒。
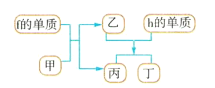
请写出h的单质与乙反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化工原料的结构简式如图所示,下列关于该有机物的说法正确的是( )
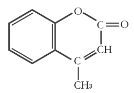
A.1 mol该物质最多能和5mol H2发生加成反应
B.能使酸性KMnO4溶液褪色,能发生加成反应和取代反应
C.该分子中所有原子都可能共平面
D.该物质的分子式为C10H10O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 100℃时,将 0.40 mol NO2 气体充入 2 L 的密闭容器中,发生如下反应:2NO2(g)![]() N2O4(g) H < 0。监测反应获得如下数据:
N2O4(g) H < 0。监测反应获得如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
下列说法正确的是
A.0~20 s 内,v(NO2) = 0.005 mol·L-1.s-1
B.若上述反应在 120℃时进行,则反应至 80 s 时,n(N2O4) < 0.08 mol
C.若仅将起始时充入 NO2 的量增至 0.80 mol,达平衡时 NO2 转化率将减少
D.59 s 时,c(NO2)一定大于 0.12 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁条置于 pH=8.4 的饱和 NaHCO3 溶液中,镁条表面产生气体 a,一段时间后产生白色沉淀b。继续进行如下实验:
Ⅰ.将 a 通过澄清石灰水,变浑浊,继而通过足量 NaOH 溶液,再通入肥皂液,出现气泡,点燃气泡听到爆鸣声;
Ⅱ.向沉淀 b 中加入足量的稀盐酸,沉淀完全溶解,且产生无色气泡。下列说法不正确的是
A.饱和 NaHCO3 溶液中,c(![]() )< c(H2CO3)
)< c(H2CO3)
B.沉淀 b 是 MgCO3
C.气体 a 中含有 CO2 和 H2
D.CO2 可能是 ![]() 水解被促进产生的
水解被促进产生的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com