
铝的阳极氧化是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。
某化学研究小组在实验室中按下列步骤模拟铝表面“钝化”的产生过程。
(1)配制实验用的溶液。要配制200 mL密度为1.2 g/cm3的溶质质量分数为16%的NaOH溶液,需要称取________g NaOH固体。
(2)把铝片浸入热的16%的NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗,写出除去氧化膜的离子方程式:________。
(3)按下图组装好仪器,接通开关K,通电约25 min。在阳极生成氧化铝,阴极产生气体。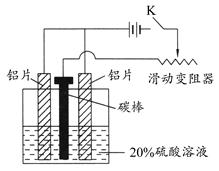
写出该过程中的电极反应式:
阳极:_________________________________________;
阴极:_________________________________________。
(4)断开电路,取出铝片,用质量分数为1%的稀氨水中和表面的酸液,再用水冲洗干净。写出该过程发生反应的离子方程式:______________________。
科目:高中化学 来源: 题型:填空题
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:
(1)硫酸渣的成分中属于两性氧化物的是 ,写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式 ;
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是 (部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:
已知: ①Cu2O +2 H+="Cu" + Cu2++H2O
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表: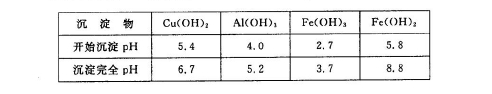
请回答下列问题:
(1)为了加快反应I的速率,可以采取的措施是 (写2点)。
(2)固体混合物A中的成分是 。
(3)反应I完成后,铁元素的存在形式为 (填离子符号);写出生成该离子的离子方程式 。
(4)操作1主要包括: 、 、 。洗涤CuSO4?5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是 。
(5)用惰性电极电解胆矾溶液一段时间,加人0.1 mol的Cu(OH)2可恢复溶液原况(浓度、成分),则电解时转移电子的物质的量为 .。
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂:0.01 mol/L酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有________中的一种或两种。
| | 实验操作 | 预期现象 | 结论 |
| 验证猜想Ⅰ | 步骤①:取少量0.01 mol/L酸性KMnO4溶液,滴入所得溶液 | | |
| 步骤②:________ | | 含有Fe3 | |
| 验证猜想Ⅱ | 将所得气体通入如下装置 | | 含有两种气体 |
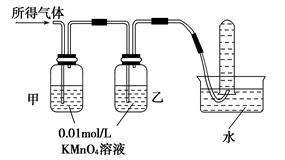
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下: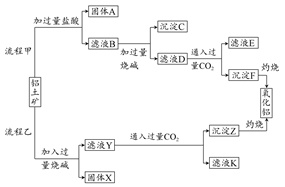
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为 。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为 。
(3)验证滤液B含Fe3+,可取少量滤液并加入 (填试剂名称)。
(4)滤液E、K中溶质的主要成分是 (填化学式),写出该溶质的一种用途: 。
(5)已在298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13,则此温度下残留在溶液中的c(Mg2+)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:___________________________。
(2)写出“联合制碱法”有关反应的化学方程式:_______________________
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?_______________________。
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应列出计算原子利用率的表达式:原子利用率(%)=_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
取A、B两份物质的量浓度相等的NaOH溶液,体积均为50 mL,分别向其中通入一定量的CO2后,再分别稀释为100 mL。
(1)在NaOH溶液中通入一定量的CO2后,溶液中的溶质的组成可能是:
① ;② ;③ ;④ 。
(2)在稀释后的溶液中分别逐滴加入0.1 mol·L-1的盐酸,产生的CO2的体积(标准状况)与所加盐酸的体积关系如图所示。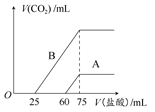
①分别加入足量的盐酸后,溶液中的溶质是 ,原NaOH溶液的物质的量浓度是 。
②A曲线表明,通入CO2后,溶液中的溶质是 ,与盐酸反应产生CO2的最大体积是 mL(标准状况)。
③B曲线表明,原NaOH溶液通入CO2后,所得溶质的化学式为 ,其物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
部分铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:
________________________________________________________________。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应: _________________________________________;
负极反应:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如图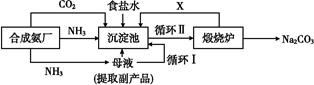
(1)上述生产纯碱的方法称 ,副产品的一种用途为 。
(2)沉淀池中发生的化学反应方程式是 。
(3)写出上述流程中X物质的分子式 。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
a.增大NH4+的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com