
【题目】下列操作或试剂选择合理的是
A.可用蒸发结晶、趁热过滤的方法提纯含少量![]() 杂质的NaCl
杂质的NaCl
B.某固体试样加水溶解,取上层清液,加KSCN溶液出现红色,原固体中一定含![]()
C.某碱性水样滴加稀盐酸无沉淀,再加![]() 溶液,出现白色沉淀,则原水样中一定含
溶液,出现白色沉淀,则原水样中一定含![]()
D.可用酸性![]() 溶液检验
溶液检验![]() 溶液中是否含有
溶液中是否含有![]()
科目:高中化学 来源: 题型:
【题目】Mg与Br2反应可生成具有强吸水性的MgBr2,该反应剧烈且放出大量热。实验室采用如图装置制备无水MgBr2。已知MgBr2+3C2H5OC2H5![]() MgBr23C2H5OC2H5,MgBr23C2H5OC2H5溶于乙醚。下列说法不正确的是( )
MgBr23C2H5OC2H5,MgBr23C2H5OC2H5溶于乙醚。下列说法不正确的是( )
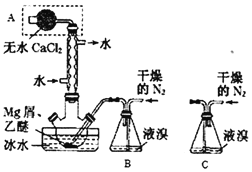
A.仪器A为干燥管,其主要作用是防止水蒸气进入反应装置
B.冷凝管的作用是导气兼起冷凝回流
C.装置B必须用干燥的N2而不能改用空气,但装置B可换成装置C
D.乙醚的作用是与MgBr2反应生成MgBr23C2H5OC2H5,并将其溶解而与Mg分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳九”是在石油提炼时获得的一系列含碳数量在9左右的烃,沸点处于汽油和柴油之间。“碳九”有两种,分为裂解碳九和重整碳九,前者主要为烷烃.烯烃等链烃,后者主要为丙苯、对甲乙米等芳香烃。下列有关说法错误的是
A.若将“碳九"添加到汽油中,可能会使汽油燃烧不充分而形成积炭
B.用溴水可以区分裂解碳九和重整碳九
C.均三甲苯(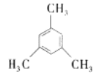 )的二氯代物有5种
)的二氯代物有5种
D.异丙苯[![]() ]和对甲乙苯(
]和对甲乙苯(![]() )互为同系物
)互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
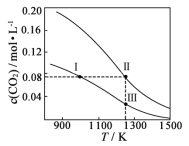
A.反应CO2(g)+C(s) ![]() 2CO(g)的ΔS>0、ΔH<0
2CO(g)的ΔS>0、ΔH<0
B.体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示。下列说法正确的是
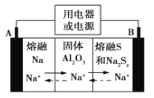
A.电子流向:A电极→用电器→B电极→电解质→A 电极
B.充电时,电极B与外接电源正极相连,电极反应式为 Sx2--2e-=xS
C.若用该电池在铁器上镀锌,则铁器应与B电极相连接
D.若用该电池电解精炼铜,电路中转移1mol电子时,阳极质量减少32 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。
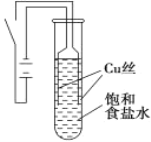
实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜 | 氯化亚铜 |
颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
相同温度下CuCl的溶解度大于CuOH
下列说法错误的是
A.反应结束后最终溶液呈碱性
B.阴极上发生的电极反应为:2H2O + 2e═ H2↑+ 2OH
C.从实验看出氢氧化亚铜具有不稳定性
D.试管底部红色的固体具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向某二元弱酸H2X的钠盐溶液中滴加盐酸,混合溶液中离子浓度与pH的关系如图所示,其中lgX =lgc(X2-)/ c(HX-) 或lgc(HX-)/c(H2X)。下列叙述不正确的是
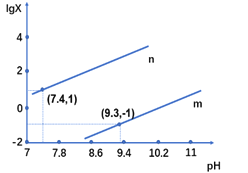
A. 当溶液呈中性时, c(HX-)>c(X2-)>c(H2X)
B. 曲线m表示lgc(X2-)/c(HX-)与pH的变化关系
C. Ka1(H2X)的数量级为10-7
D. 25℃时,NaHX溶液中:c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
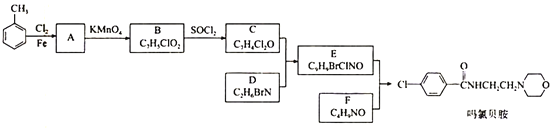
【题目】某研究小组按下列路线合成抗抑郁药物吗氯贝胺
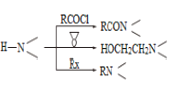
已知:
请回答:
(1)化合物B的官能团名称___________,![]() →A的反应试剂和条件是__________
→A的反应试剂和条件是__________
(2)化合物F的结构简式是______________________
(3)写出C+D→E的化学方程式____________________________________________
(4) 为探索新的合成路线,发现用化合物C与X(C6H14N2O)一步反应即可合成吗氯贝胺。请结合相关信息及知识,设计以环氧乙烷( ![]() )为原料合成X的合成路线_______________(用流程图表示,无机试剂任选)。
)为原料合成X的合成路线_______________(用流程图表示,无机试剂任选)。
(5)符合以下条件的化合物X(C6H14N2O)可能的同分异构体有___________种。其中只有一条侧链的同分异构体的结构简式为________________
①分子中有一个六元环,且成环原子中最多含一个非碳原子。
②1H-NMR谱显示分子中有5种氢原子;IR谱表明分子中有N-N键,无O-H键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
则CO2催化氢化合成甲醇的热化学方程式:______________________。
(2)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的密度不变
C.混合气体的相对平均分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
(3)如表所列数据是反应在不同温度下的化学平衡常数(K)
温度℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①该反应的化学平衡常数表达式为K=_____。
②由表中数据判断该反应的△H_____0(填“>”、“=”或“<”);
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为___________℃。
(4)要提高CO的转化率,可以采取的措施是(填字母序号)__________________.
a.增加CO的浓度 b.加入催化剂 c.升温 d.加入H2 e.加入惰性气体 f.分离出甲醇
(5)在一定条件下,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(![]() )与L和X的关系如图所示,L和X分别表示温度或压强。
)与L和X的关系如图所示,L和X分别表示温度或压强。
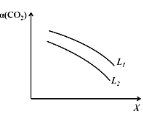
①X表示的物理量是_____。
②判断L1与L2的大小关系:L1_____L2(填“<”,“=”或“>”),并简述理由:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com