
【题目】下列说法正确的是 ( )
A.生产陶瓷的主要原料是石灰石和黏土
B.普通玻璃的主要成分只含有二氧化硅
C.二氧化硅可用来生产光纤
D.碳化硅又叫石英砂,可用作砂轮和砂纸的磨料
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g) ![]() H2NCOONH4(s) △H=-272KJ·mol-1
H2NCOONH4(s) △H=-272KJ·mol-1
第二步:H2NCOONH4(s) ![]() CO(NH2)2(s)+H2O(g) △H=+138kJ·mol-1
CO(NH2)2(s)+H2O(g) △H=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:______________________。
(2)一定温度下,向2L恒容密闭容器中通入2molCO和1mol SO2,发生反应2CO(g)+SO2(g) ![]() 2CO2(g)+S(s)。若反应进行到20min时达平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)=_________,该温度下反应化学平衡常数K=__________。
2CO2(g)+S(s)。若反应进行到20min时达平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)=_________,该温度下反应化学平衡常数K=__________。

(3)工业上可用NaC1O碱性溶液或“亚硫酸盐法”吸收SO2。
①为了提高吸收效率,常用Ni2O3作为催化剂。催化过程如图所示:
a.过程2的离子方程式_______________________________。
b.Ca(C1O)2也可用于脱硫,且脱硫效果比NaC1O更好,原因是________________。
②室温条件下,将烟气通入(NH4)2SO4溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示,b点时溶液pH=7,则n(NH4+):n(SO32-)=__________。
(4)用食盐水做电解液电解烟气脱氮的原理如图,NO被阳极产生的氧化性物质氧化为NO3-,尾气经氢氧化钠溶液吸收后排入空气。如下图,电流密度和溶液pH对烟气脱硝的影响。

①NO被阳极产生的氧化性物质氧化为NO3-反应的离子方程式___________________。
②溶液的pH对NO去除率影响的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾KAl(SO4)2.12H2O]在造纸等方面应用广泛。实验室中采用废易拉罐(含有Al和少量Fe、Mg杂质)制备明矾的流程如图所示:
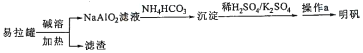
下列叙述错误的是
A. 回收处理废易拉罐有利于保护环境和资源再利用
B. “沉淀”为Al2(CO3)3
C. “操作a”中包含蒸发浓缩、冷却结晶
D. 上述流程中可用过量CO2代替NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学试剂应根据其性质和形态进行有效妥善保存:
(1)固体试剂应保存在____________中,液体试剂保存在____________中,见光易分解的试剂(如:浓HNO3、AgNO3等)应用____________色试剂瓶保存。氢氟酸(HF)因和玻璃中的SiO2强烈反应而腐蚀玻璃,应用____________存放;金属钠、钾应保存在____________中;少量白磷应该保存在____________中。
(2)新制氯水需保存在棕色试剂瓶中,原因是__________________。
(3)实验室新配制的硫酸亚铁溶液,一般要加入少量___________,防止在空气中变质。
(4)在盛放浓硫酸的试剂瓶标签上印如下列警示标记,说明浓硫酸具有_______性。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D四种分子所含原子的数目依次为1、3、6、2,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1∶2。D物质的氢化物能刻蚀玻璃。
(1)A的分子式是________,写出A原子的价层电子排布式________。
(2)B分子的中心原子的杂化类型是________,分子空间构型是________,该分子属于________分子(填“极性”或“非极性”)。
(3)C的化学式是________,分子中含有的化学键类型是________。
(4)D物质的氢化物的沸点比HCl的沸点高,其主要原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素性质呈周期性变化的决定因素是( )
A. 元素原子半径大小呈周期性变化
B. 元素相对原子质量依次递增
C. 元素原子最外层电子排布呈周期性变化
D. 元素的最高正化合价呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其pH与溶液体积V的关系如图所示。

下列说法正确的是( )
A. A、B两酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液强
C. a=5时,A是强酸,B是弱酸
D. 若A、B都是弱酸,则5≥a>2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中所示的装置图能够达到实验目的是
A.  用图A所示配制一定浓度的稀硫酸
用图A所示配制一定浓度的稀硫酸
B.  用图B装置,实验室制备Fe(OH)2
用图B装置,实验室制备Fe(OH)2
C.  用图C所示实验,可比较氯、碳、硅三种元素的非金属性强弱
用图C所示实验,可比较氯、碳、硅三种元素的非金属性强弱
D.  用图D加热熔融NaOH固体
用图D加热熔融NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X(g)+2Y(g)![]() Z(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(X)=0.100 mol·L-1,c(Y)=0.200 mol·L-1,c(Z)=0 mol·L-1。反应物X的浓度随时间的变化如图所示。
Z(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(X)=0.100 mol·L-1,c(Y)=0.200 mol·L-1,c(Z)=0 mol·L-1。反应物X的浓度随时间的变化如图所示。
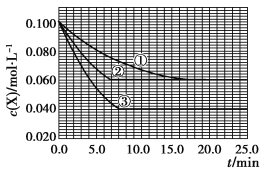
下列说法正确的是
A. 若反应①、②的平衡常数分别为K1、K2,则K1<K2
B. 实验②平衡时Y的转化率为60%
C. 减小反应③的压强,可以使平衡时c(X)=0.060 mol·L-1
D. 反应X(g)+2Y(g) ![]() Z(g)的ΔH>0
Z(g)的ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com