
分析 (1)发生的反应方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(2)20g沉淀为碳酸钙,根据方程式计算碳酸钠的物质的量,再根据c=$\frac{n}{V}$计算;
(2)发生反应:CaCO3+2HCl=CaCl2+CO2↑+H2O,据此计算生成二氧化碳的体积.
解答 解:(1)发生的反应方程式Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,答:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(2)令碳酸钠的物质的量为x mol,则:
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
1mol 100g
xmol 20g
1mol:xmol=100g:20g
解得x=0.2
碳酸钠的物质的量浓度=$\frac{n}{V}$=$\frac{0.2mol}{0.25L}$=0.8mol/L,
答:碳酸钠的物质的量浓度为0.8mol/L;
(3)设标况下生成二氧化碳的体积为V L,则:
CaCO3+2HCl=CaCl2+CO2↑+H2O
100g 22.4L
20g V L
100g:20g=22.4L:V L
解得V=4.48,
答:标况下生成二氧化碳的体积为4.48L.
点评 本题考查化学方程式的有关计算、物质的量的计算,比较基础,侧重对基础知识的巩固.


科目:高中化学 来源: 题型:解答题
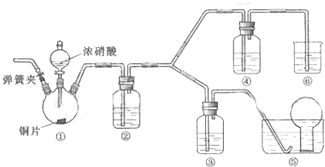
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
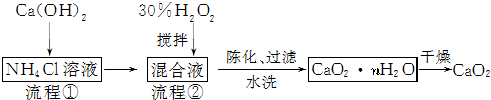

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液中加入铜粉:Ag++Cu=Cu2++Ag | |
| B. | 氧化钠投入水中发生反应:O2-+H2O=2OH- | |
| C. | 向澄清石灰水中通入足量二氧化碳:OH-+CO2=HCO3- | |
| D. | 金属铁溶于稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| C. | 核外电子排布相同的微粒化学性质也相同 | |
| D. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断开氢气中的H-H键 | B. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 | ||
| C. | C与H2O(g)反应 | D. | Na与H2O反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
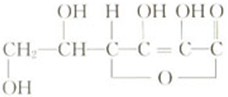 维生素C的结构式如下,
维生素C的结构式如下,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com