
| A、所处的周期序数:C=N<Si | B、原子半径:Si>C>N | C、最高化合价:Si>C>N | D、非金属性:N>C>Si |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 (2013?济宁二模)已知尿素的结构式为:
(2013?济宁二模)已知尿素的结构式为: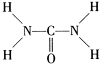 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.
尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.| 234 |
| ρNA |
| 234 |
| ρNA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)依据第2周期元素第一电离能的变化规律,参照如图中B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置.
(1)依据第2周期元素第一电离能的变化规律,参照如图中B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置.查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省潍坊市高三3月第一次模拟考试化学试卷(解析版) 题型:填空题
本题包括A、B两小题,请选定其中一小题并在相应的答
题区域内作答。若多做,则按A小题评分。
A.【物质结构与性质】
元素H、C、N、O、F都是重要的非金属元素,Fe、Cu是应用非常广泛的金属。
(1)Fe元素基态原子的核外电子排布式为 。
(2)C、H元素形成的化合物分子中共有16个电子,该分子中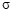 键与
键与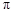 键的个数比为
键的个数比为
。
(3)C、N、O三种元素的第一电离能由大到小的顺序为(用元素符号表示)
。
(4)在测定HF的相对分子质量时,实验测得值一般高于理论值,其主要原因是
。
(5)C、N两元素形成的化合物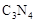 形成的原子晶体,结构类似
形成的原子晶体,结构类似
金刚石,甚至硬度超过金刚石,其原因是 。
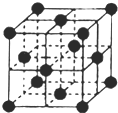
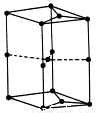
(6)右图为石墨晶胞结构示意图,该晶胞中含有C原子的个数为 。
B.【有机化学基础】
扑热息痛(学名对乙酸氨基酚)是生活中常用到的一种解热镇痛药。以苯为原料合成扑热息
痛的部分转化如下:

请回答下列问题:
(1)B C的反应类型为 ,D中官能团的名称为 。
C的反应类型为 ,D中官能团的名称为 。
(2)C的结构简式为 。
(3)1mol扑热息痛与足量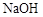 溶液反应,理论上消耗
溶液反应,理论上消耗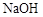 的物质的量为 mol。
的物质的量为 mol。
(4)实验证明B能够与溴水反应,试写出其反应的化学方程式 。
(5)扑热息痛有多种同分异构体,同时符合下列要求的同分异构体有 种。
①苯环上有两个对位取代基;②同于氨基酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
对C、N、Si三种元素的叙述错误的是
A.所处的周期序数:C=N<Si B.原子半径:Si>C>N
C.最高化合价:Si>C>N D.非金属性:N>C>Si
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com