
N2(g)+3H2(g) 2NH3(g) △H<0。当反应达到平衡时,下列措施能提高N2转化率的是
2NH3(g) △H<0。当反应达到平衡时,下列措施能提高N2转化率的是
① 降温 ② 恒压通入惰性气体 ③ 增加N2的浓度 ④ 加压
A.①④ B.①② C.②③ D.③④
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成的化学键中共价键成分最少的是( )
A.Li,F B.Na,F
C.Na,Cl D.Mg,O
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,①6.72 L CH4气体 ②3.01×1023个HCl气体分子 ③13.6 g H2S气体 ④0.2 mol NH3,按下列要求对这四种气体的关系从大到小进行排列(用上述数字序号表示):
(1)标准状况下四种气体的体积 .
(2)四种气体的质量 .
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,用Na2SO3溶液吸收SO2时,溶液pH随n(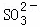 ):n(
):n(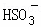 ) 变化的关系如表:
) 变化的关系如表:
| n( | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
以下离子浓度关系的判断正确的是( )
|
| A. | NaHSO3溶液中c(H+)<c(OH﹣) |
|
| B. | Na2SO3溶液中c(Na+)>c (SO32﹣)>c(HSO3﹣)>c(OH﹣)>c(H+) |
|
| C. | 当吸收液呈中性时,c(Na+)>c(SO32﹣)>c(HSO3﹣)>c(OH﹣)=c(H+) |
|
| D. | 当吸收液呈中性时,c(Na+)=c(HSO3﹣)+2c(SO32﹣) |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于材料的说法中,正确的是
A.光导纤维是信息社会必不可少的有机合成材料
B.棉布、羊毛和涤纶燃烧后都只生成二氧化碳和水
C.航天飞机上的陶瓷防护片属于新型无机非金属材料
D.食品保鲜膜、塑料水杯等生活用品的主要成分是聚氯乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常用氯氧化法处理含氰(CN-)废水,一定条件下,氯气和CN-反应生成无毒气体。下列说法不正确的是
A.CN-中碳元素的化合价为+2
B.该反应的产物之一是无毒的N2
C.当1 mol CN-参与反应时,转移3 mol e-
D.处理含0.1 mol CN-的废水,理论上需要消耗标准状况下Cl2的体积为5.6 L
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示。
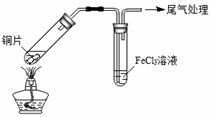
A B
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
| 步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A。 |
FeCl3溶液显酸性的原因是 。写出装置A中产生SO2的化学方程式: 。
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因: 。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式: 。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验。
| 步骤② | 往5 mL 1 mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
| 步骤③ | 往5 mL重新配制的1 mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为 。
(4)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III. 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在NH3•H2O NH4++OH﹣形成的平衡中,要使NH3•H2O的电离程度及c(OH﹣)都增大,可采取的措施是
NH4++OH﹣形成的平衡中,要使NH3•H2O的电离程度及c(OH﹣)都增大,可采取的措施是
A.通入HCl B.加少量NaOH固体
C.加少量氯化铵固体 D.加热
查看答案和解析>>
科目:高中化学 来源: 题型:
通过血液中的钙离子的检测能够帮助判断多种疾病。某研究小组为测定血液样品中Ca2+的含量(100 mL血液中含Ca2+的质量),实验步骤如下:
①准确量取5.00 mL血液样品,处理后配制成50.00 mL溶液;
②准确量取溶液10.00 mL,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入12.00 mL 0.0010 mol·L-1的KMnO4溶液,使H2C2O4完全被氧化,离子方程式为:
2MnO4- +5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
⑤用0.0020 mol·L-1 (NH4)2Fe(SO4)2溶液滴定过量的KMnO4溶液,消耗(NH4)2Fe(SO4)2溶液20.00 mL。
(1)已知室温下CaC2O4的Ksp=2.0×10-9,欲使步骤②中
c(Ca2+)≤1.0×10-5 mol·L-1,应保持溶液中c(C2O42 -)≥ mol·L-1。
(2)步骤⑤中有Mn2+生成,发生反应的离子方程式为 。
(3)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,测得血液中Ca2+的含量将 (填“偏高”、“偏低”或“不变”)。
(4)计算血样中Ca2+的含量 g/mL(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com