
【题目】I.氢氧燃料电池是符合绿色化学理念的新型发电装置,如图1为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
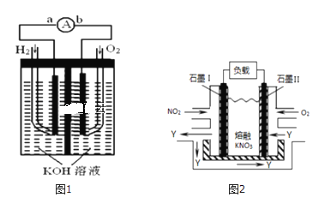
(1)负极反应式为______.
(2)电极表面镀铂粉的原因为______.
II.分析下列电解过程:
(1)写出惰性电极电解CuSO4溶液的总反应的离子方程式:______;
(2)写出惰性电极电解NaCl溶液的阳极反应式______;电解一段时间后加______(填物质名称)恢复电解前状况.
III.NO2、O2和熔融KNO3可制作燃料电池,其原理如图2
(1)请写出负极的电极方程式:______.
(2)相同条件下,放电过程中消耗的NO2和O2的体积比为______.
【答案】H2+2OH--2e-=2H2O 增大电极单位面积吸附H2、O2的分子数,加速电极反应速率 2Cu2++2H2O![]() 2Cu+O2↑+4H+ 2Cl—2e-=Cl2↑ 氯化氢 NO2+NO3—-e-=N2O5 4:1
2Cu+O2↑+4H+ 2Cl—2e-=Cl2↑ 氯化氢 NO2+NO3—-e-=N2O5 4:1
【解析】
(Ⅰ)(1)燃料电池中,通入燃料的电极是负极;
(2)根据“电池电极表面镀一层细小的铂粉,吸附气体的 能力强,性质稳定”来回答;
(Ⅱ)(1)惰性电极电解CuSO4溶液,根据电极反应和放电顺序写出总反应方程式;
(2)惰性电极电解NaCl溶液生成氢氧化钠、氯气和氢气,若想恢复电解前状况,电解过程中出什么加什么;
(Ⅲ)根据通入气体判断两极,电极反应式和电池反应式,根据电池总反应4NO2+O2=2N2O5计算。
(Ⅰ) (1)燃料电池中,通入燃料氢气的电极是负极,发生电极反应:![]() ,故答案为:
,故答案为:![]() ;
;
(2)根据题目信息:“电池电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定”,可知电极表面镀铂粉的原因为增大气体的吸附面积,保证气体充分参与电极反应,
故答案为:增大电极单位面积吸附H2、O2的分子数,加速电极反应速率;
(Ⅱ)(1)惰性电极电解CuSO4溶液,阳极是氢氧根离子失电子发生氧化反应,电极反应为:![]() ,阴极电极反应为:
,阴极电极反应为:![]() ,总反应方程式为:
,总反应方程式为:![]() ,
,
故答案为:![]() ;
;
(2)惰性电极电解NaCl溶液生成氢氧化钠、氯气和氢气,反应的离子方程式为:![]() ,阳极反应式:
,阳极反应式:![]() ,若想恢复电解前状况,电解过程放出氢气和氯气,所以加入氯化氢恢复溶液浓度,
,若想恢复电解前状况,电解过程放出氢气和氯气,所以加入氯化氢恢复溶液浓度,
故答案为:![]() ;氯化氢;
;氯化氢;
(Ⅲ)(1)据题意,通O2一极为正极,电极反应式为![]() ;通NO2一极为负极,电极反应为:
;通NO2一极为负极,电极反应为:![]() ,
,
故答案为:![]() ;
;
(2)通O2一极为正极,电极反应式为![]() ;通NO2一极为负极,电极反应为:
;通NO2一极为负极,电极反应为:![]() ,得到电池总反应
,得到电池总反应![]() ,相同条件下,放电过程中消耗的NO2和O2的体积比为4:1,
,相同条件下,放电过程中消耗的NO2和O2的体积比为4:1,
故答案为:4:1。


科目:高中化学 来源: 题型:
【题目】某地有软锰矿(主要成分 MnO2,含少量 SiO2 和 Al2O3)和闪锌矿(主要成分 ZnS,含少量 FeS、CuS 和 CdS)两座矿山。综合利用的工艺如下,主产品是通过电解获得的锌和二氧化锰,副产品为硫磺、少量金属铜和镉。生产中除矿石外,只需购入少量的硫酸和纯碱。
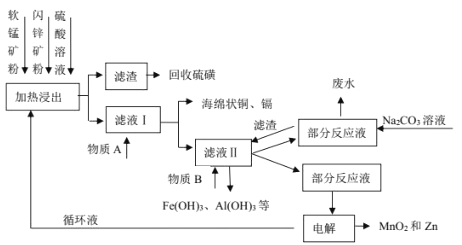
(1)以 FeS 为例,写出生成硫磺的反应方程式____。
(2)回收的硫磺可用于制取石硫合剂:在反应器内加水使石灰消解,然后加足量水,在搅拌下把硫磺粉慢慢倒入,升温熬煮,使硫发生歧化反应,先得到白色浑浊液,进一步反应得粘稠状深棕色液体,并残留少量固体杂质。制备中先得到的白色浑浊物是________________,残留的固体杂质可能是_________________。
(3)写出物质 A 和 B的化学式_____、_____。
(4)不在滤液Ⅱ中直接加入 Na2CO3 的原因是_____。
(5)电解时的阴极材料为_____,阳极的电极反应式为_______________。
(6)已知 H2CO3 的 Ka1=4×10-7,Ka2=5×10-11,则浓度均为 0.5mol/L 的 Na2CO3 和 NaHCO3 的混合溶液的 pH 约为___________(lg4=0.6,lg5=0.7),溶液中含碳微粒的浓度从大到小的顺序为_____向此溶液中不断滴加 1mol/L 稀 HCl 时,溶液中 c(CO32-)的变化曲线如下图所示,请在图中画出溶液中其它含碳微粒浓度变化的曲线。_________________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对X2 (g)+3Y2 (g)=2XY3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量),下列判断正确的是
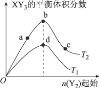
A.若T2>T1,则正反应一定是放热反应
B.T2和n (X2)不变,达到平衡时,XY3的物质的量:c>b>a
C.T2和n(X2)不变,达到平衡时,X2的转化率:b>a>c
D.若T2>T1,达到平衡时b、d点的正反应速率:v(d)>v (b)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取0.2 mol·L-1 HX溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列关于混合溶液的说法(或关系式)正确的是
A.c(Na+)-c(X-)=9.9×10-7 mol·L-1
B.c(Na+)=c(X-)+c(HX)=0.2 mol·L-1
C.c(OH-)-c(HX)=c(H+)=1×10-6 mol·L-1
D.c(Na+)>c(X-)>c(HX)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.Fe(OH)3 溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O
B.K2S 溶液中加入AgCl 固体反应的离子方程式为:2AgCl+S2-===2Cl-+Ag2S
C.苯酚钠溶液中通入少量二氧化碳: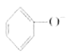 +CO2+H2O→
+CO2+H2O→![]() +CO32-
+CO32-
D.溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】峨眉金顶摄身崖又称舍身崖,因常现佛光而得名。“佛光”因摄入身之影像于其中,遂称“摄身光”,为峨眉胜景之一。摄生崖下土壤中富含磷矿,所以在无月的黑夜可见到崖下荧光无数。
(1)“荧光”主要成分是 PH3(膦),其结构式为 __________ ,下列有关 PH3 的说法错误的是___________ 。
a.PH3 分子是极性分子
b.PH3 分子稳定性低于 NH3 分子,因为 N-H 键键能高
c.一个 PH3 分子中,P 原子核外有一对孤电子对
d.PH3 沸点低于 NH3 沸点,因为 P-H 键键能低
(2)PH3 的沸点比 NH3______填“高”或“低”) NH3 的水溶液碱性_____PH3 的水溶液碱性(填“大于”或“小于”);氯化鏻(PH4C1)与碱反应生成膦的离子方程式为 _______________________ 。
(3)PH3 是一种还原剂,其还原能力比 NH3 强,通常情况下能从Cu2+、Ag+、Hg2+等盐溶液中还原出金属, 而本身被氧化为最高氧化态。PH3 与 CuSO4 溶液反应的化学方程式为 ______________。
(4)“荧光”产生的原理是Ca3P2 在潮湿的空气中剧烈反应,写出该反应的化学方程式__________________。
(5)PH3 有毒,白磷工厂常用 Cu2+、Pd2+液相脱除 PH3:PH3+2O2![]() H3PO4,其他条件相同时, 溶解在溶液中O2 的体积分数与 PH3 的净化效率与时间的关系如图所示,回答下列问题:
H3PO4,其他条件相同时, 溶解在溶液中O2 的体积分数与 PH3 的净化效率与时间的关系如图所示,回答下列问题:
①由图可知,富氧有利于______(选填“延长”或“缩短”)催化作用的持续时间。
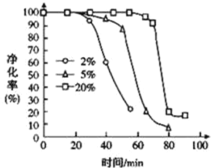
②随着反应进行,PH3 的净化效率急剧降低的原因可能为 _________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是( )
A.过量的铁在1molCl2中然烧,最终转移电子数为2NA
B.在50g质量分数为46%的乙醇水溶液中,含氢原子总数为6NA
C.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
D.1L1mol/LNaF溶液中F-的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用硫酸酸化的高锰酸钾溶液与草酸溶液反应测定单位时间内生成CO2的量来探究影响反应速率的因素。设计实验方案如表:
实验序号 | A溶液 | B溶液 |
① | 20mL0.1mol·L-1H2C2O4溶液 | 30mL0.02mol·L-1酸性KMnO4溶液 |
② | 20mL0.2mol·L-1H2C2O4溶液 | 30mL0.02mol·L-1酸性KMnO4溶液 |
(1)图1装置中盛放A溶液的仪器名称是_____,检验如图1装置气密性的方法为_____。

(2)硫酸酸化的高锰酸钾溶液与草酸溶液反应的化学反应方程式为_____。
(3)此实验探究的是_____因素对化学反应速率的影响,若实验②在40s末收集了22.4mLCO2(标准状况下),则在40s内,v(MnO4-)=_____(忽略溶液混合前后体积的变化)。
(4)小组同学将图1的气体收集装置改为图2,实验完毕冷却后,读数时发现量气管液面高于干燥管液面,为得到准确数据,采取的操作是:____。
(5)除了通过测定单位时间内生成CO2的体积来比较反应速率,本实验还可以通过测定____来比较化学反应速率。
(6)同学们在实验中发现反应速率总是如图3所示,探究t1~t2时间内速率变快的主要原因可能是:____。
A.该反应放热 B.生成的Mn2+起催化作用 C.K2SO4浓度增大

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3、NOx、SO2处理不当易造成环境污染,如果对这些气体加以利用就可以变废为宝,既减少了对环境的污染,又解决了部分能源危机问题。
(l)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。已知:
![]() ①
①
![]() ②
②
则反应![]() (1)△H=_______
(1)△H=_______
(2)工业上利用氨气生产氢氰酸(HCN)的反应为:
①在一定温度条件下,向2L恒容密闭容器中加入2 mol CH4和2 mol NH3,平衡时NH3体积分数为30%,所用时间为10 min,则该时间段内用CH4的浓度变化表示的反应速率为______ mol·L-l·min-1,该温度下平衡常数K= ___。若保持温度不变,再向容器中加入CH4和H2各1 mol,则此时v正 ___(填“>”“=”或“<”)v逆 。
②其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图1所示。X代表 ___(填字母代号)。
A 温度 B 压强 C 原料中CH4与NH3的体积比
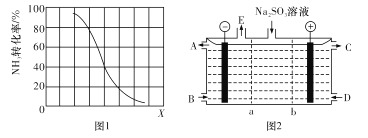
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3进行电解生产硫酸,其中阴、阳膜组合电解装置如图2所示,电极材料为石墨。A--E分别代表生产中的原料或产品,b表示____(填“阴”或“阳”)离子交换膜。阳极的电极反应式为_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com