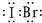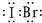【答案】
分析:(1)氯原子获得1个电子形成氯离子,氯离子核外有18个电子,有3个电子层,由里到外各层电子数为2、8、8;
(2)IBr的结构与氯气类似,碘原子与溴原子直接形成1对共用电子对;
溴元素的电负性更多,吸引键合电子的能力强;
(3)F元素电负性很大,HF分子之间存在氢键,沸点较高;
(4)次氯酸是弱酸,高氯酸、硫酸属于强酸,非金属性越强,最高价含氧酸的酸性越强;
(5)利用氯水与溴化钠反应,再通过萃取检验生成溴.
解答:解:(1)氯原子获得1个电子形成氯离子,氯离子核外有18个电子,有3个电子层,由里到外各层电子数为2、8、8,氯离子结构示意图为:
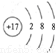
,
故答案为:

;
(2)IBr的结构与氯气类似,碘原子与溴原子直接形成1对共用电子对,电子式为
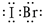
;
溴元素的电负性更多,吸引键合电子的能力强,故Br为-1价,
故答案为:
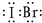
;-1;
(3)F元素电负性很大,HF分子之间存在氢键,故氟化氢气体的沸点较高,
故答案为:氢键;
(4)次氯酸是弱酸,高氯酸、硫酸属于强酸,非金属性越强,最高价含氧酸的酸性越强,故酸性HClO
4>H
2SO
4>HClO,
故答案为:①③②;
(5)利用氯水与溴化钠反应,再通过萃取检验生成溴,具体操作与现象为:取少量的溴化钠溶液置于一支洁净的试管中,加入少量四氯化碳溶液,在试管中滴加适量新制氯水,充分振荡,观察到下层油层呈橙(橙红)色,
故答案为:取少量的溴化钠溶液置于一支洁净的试管中,加入少量四氯化碳溶液,在试管中滴加适量新制氯水,充分振荡,观察到下层油层呈橙(橙红)色.
点评:本题考查常用化学用语、氢键对物质性质的影响、元素周期律、卤素单质之间的置换等,难度不大,是对学生综合能力的考,注意基础知识的理解掌握.

 ,
, ;
;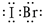 ;
;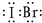 ;-1;
;-1;

 阅读快车系列答案
阅读快车系列答案
 ,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为
,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为